Azinfarbstoffe
Azinfarbstoffe sind eine Gruppe organischer Farbstoffe die als gemeinsames Strukturelement einen stickstoffhaltigen ungesättigten Sechsring-Heterocyclus aus der Stoffgruppe der Azine aufweisen. Neben dem Stickstoffatom enthält der Azin-Ring mit Sauerstoff, Schwefel oder einem zusätzlichen Stickstoff ein weiteres Heteroatom[Anm. 1] und ist mit zwei Benzolringen anelliert, die wiederum mit auxochromen Gruppen – meist Amino- oder Hydroxylgruppen – substituiert sind:[1]
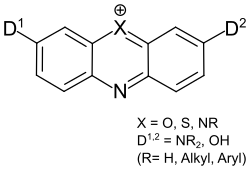
Die Azinfarbstoffe mit einem 1,4-Diazin-Ring, bzw. einem Phenazin-Strukturelement werden als Phenazinfarbstoffe bezeichnet. Entsprechend besitzen Phenoxazinfarbstoffe einen 1,4-Oxazin-Ring, bzw. ein Phenoxazin-Strukturelement[2] und die Phenothiazinfarbstoffe einen 1,4-Thiazin-Ring, bzw. ein Phenothiazin-Strukturelement.[3][4]
Da die Hydroxyazinfarbstoffe überwiegend in der Ketoform vorliegen, werden sie auch als Phenazon-, Phenoxazon- und Phenothiazonfarbstoffe bezeichnet.
.svg.png)
Abhängig von den weiteren Substituenten im Molekül können die Azinfarbstoffe zu den kationischen, anionischen oder neutralen Farbstoffen gehören.
Geschichte

Die ältesten synthetischen Farbstoffe gehören zur Gruppe der Azinfarbstoffe. 1856 wurde von William Henry Perkin der violette Phenazinfarbstoff Mauvein entdeckt, der als Acetat-Salz zum Färben von Seide im industriellen Maßstab produziert wurde. Dies wird als Geburtsstunde der Farbstoffindustrie und damit der chemischen Industrie angesehen.[5] Weitere Phenazinfarbstoffe auf der Basis von Anilin waren Anilinschwarz, das ab 1863 in einem industriellen Verfahren hergestellt wurde und die Nigrosine, die 1868 entdeckt wurden.[6]
Der erste Phenothiazinfarbstoff war Thionin das 1876 von Charles Lauth erfunden und daher auch als Lauths Violett bezeichnet wurde. Größere Bedeutung für diese Farbstoffklasse erlangte jedoch das im gleichen Jahr von Heinrich Caro bei der BASF entwickelte Methylenblau.[1]
Der älteste industriell produzierte Phenoxazinfarbstoff ist Meldola-Blau, dessen Synthese als Kondensationsreaktion von nitrosiertem N,N-Dimethylanilin mit 2-Naphthol 1879 von Raphael Meldola veröffentlicht wurde.[7] 1890 wurde Triphendioxazin beschrieben – eine Verbindung die zwei Oxazin-Strukturelemente aufweist.[8] Die Synthese wurde bereits 1879 veröffentlicht, ohne dass jedoch zu diesem Zeitpunkt die korrekte Struktur zugeordnet werden konnte.[9] Farbstoffe mit einem Triphendioxazin-Chromophor wie beispielsweise Direct Blue 108 wurden 1928 patentiert.[10]
Synthese
Die wichtigste Methode zur Synthese von Azinfarbstoffen ist die Cyclisierung von Chinoniminfarbstoffen und nachfolgender Oxidation.
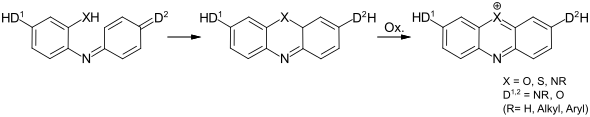
Dabei kann das Heteroatomgruppe XH bereits über eine der beiden Komponenten des Chinoniminfarbstoffs oder in einem separaten Schritt auf der Stufe des Chinoniminfarbstoffs eingeführt werden. Die Phenoxazinfarbstoffe werden nach der ersten Variante synthetisiert, während die Phenothiazinfarbstoffe nach der zweiten Synthesevariante hergestellt werden. Bei den Phenazinfarbstoffen gibt es beide Vorgehensweisen.
Eigenschaften
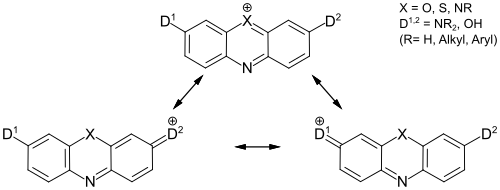
Die intensive Farbigkeit der Azinfarbstoffe ergibt sich aus den mesomeren Grenzstrukturen, die sich für die Verbindungen formulieren lassen:[1]
Phenazinfarbstoffe
Mit den Phenazinfarbstoffen kann Wolle, Seide und Leder direkt und Baumwolle nach dem Beizen, beispielsweise mit Tanninen, gefärbt werden. Bedeutsam sind sie jedoch nur noch als Lederfarbstoffe und für das Färben von Papierpulpe. Nigrosine werden beispielsweise in Schuhcremes oder in Tinten für Tintenstrahldrucker eingesetzt. Bei der Verwendung von aromatischen Mono- und Diaminen als Oxidationsfarbstoffe bei der Haarfärbung bilden sich ebenfalls Phenazinfarbstoffe.[1]
Die Phenazinfarbstoffe können je nach Anzahl und Art der auxochromen Gruppen in Monoamino-, Diamino-, Aminohydroxy- und Monohydroxyphenazinfarbstoffe eingeteilt werden. Die größte Bedeutung haben die Diaminophenazinfarbstoffe, während die Aminohydroxy- und Monohydroxyphenazinfarbstoffe keine industrielle Bedeutung mehr haben.[1]
| Beispiele für Phenazinfarbstoffe | |||
|---|---|---|---|
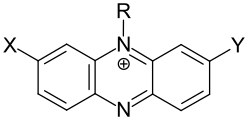
| |||
| Gruppe | X | Y | Beispiel |
| Monoaminophenazinfarbstoffe | -NR2 | – | 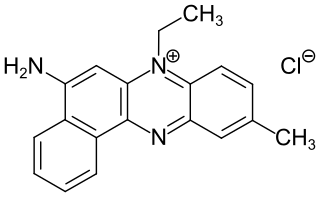 Indulinscharlach (C.I. 50080) |
| Diaminophenazinfarbstoffe | -NR2 | -NR2 | 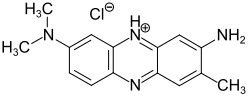 Neutralrot (C.I. 50040) |
| Aminohydroxyphenazinfarbstoffe | -NR2 | -OH | -3-hydroxy-5-phenylphenazinium.svg.png) 3-(Diethylamino)-7-hydroxy-5-phenylphenazin-5-ium-Kation[S 1] |
| Monohydroxyphenazinfarbstoffe | – | -OH | 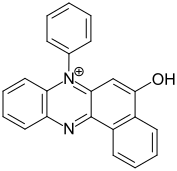 Rosindon[Anm. 2][11] |
| R = H, Alkyl. Aryl | |||
Synthese
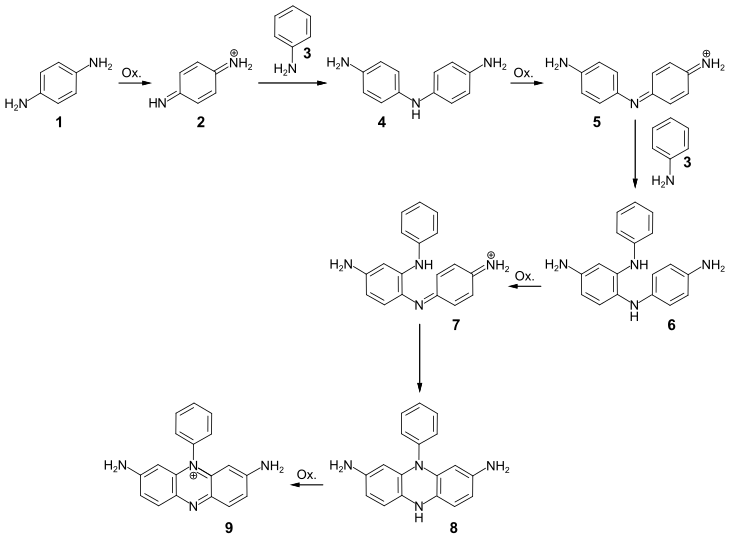
Eine typische Synthese von Phenazinfarbstoffen ist die oxidative Kondensation aromatischer Amine und Diamine. So erhät man beispielsweise durch die gemeinsame Oxidation von p-Phenylendiamin (1) und Anilin (3) den Phenazinfarbstoff Phenosafranin (9). Detaillierte Untersuchungen des Reaktionsmechanismus zeigen, dass zunächst p-Phenylendiamin schnell zum 1,4-Benzochinondiimin (2) oxidiert wird. Die konjugierte Säure der Zwischenstufe regiert mit Anilin zu 4,4′-Diaminodiphenylamin (4). Die Weiteroxidation führt zu Bildung der Indamin-Verbindung 5, die mit Anilin zur Zwischenstufe 6 reagiert. Nach der Oxidation zum Chinoniminfarbstoff 7 erfolgt die Cyclisierung zur substituierten Dihydrophenazin-Zwischenstufe 8, die schließlich zum Phenosafranin oxidiert wird:[12]
Alternativ können zur Synthese von Phenazinfarbstoffen auch nitrosierte tertiäre aromatische Amine eingesetzt werden.
Phenoxazinfarbstoffe
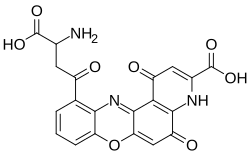
Kationische Mono- und Diamiophenoxazine werden zur Färbung von Synthesefasern wie beispielsweise Polyacrylnitrilfasern verwendet.[13] Ein weiteres Anwendungsgebiet für Phenoxazinfarbstoffe ist in der Lasertechnologie bei Farbstofflasern.[14]
Die Leukoverbindungen der Aminophenoxazin- und Hydroxyphenoxazinfarbstoffe eignen als hochempfindliche Sauerstoffdetektoren. Die Farbstoffe werden für die analytische Bestimmung von Ascorbinsäure und als anodische elektrochrome Materialien beispielsweise bei Rückspiegeln, Sonnendächern oder Fenstern verwendet. Diaminophenoxazinfarbstoffe wie beispielsweise Brillantkresylblau finden in der Mikroskopie zum Anfärben von Präparaten Anwendung.[1]
Es gibt einige wenige natürlich vorkommende Phenoxazine wie zum Beispiel der Chromophor des Antibiotikums Actinomycin D, der aus den Flügelpigmenten und Sekreten von Insekten isolierte Farbstoff Xanthommatin oder der in Flechten vorkommende Pflanzenfarbstoff Orcein (C.I. Natural Red 28).[15]
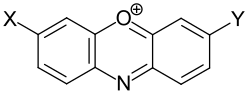
| Beispiele für Phenoxazinfarbstoffe | |||
|---|---|---|---|
| |||
| Gruppe | X | Y | Beispiel |
| Monoaminophenoxazinfarbstoffe | -NR2 | - | .svg.png) Basic Blue 6 (C.I. 51175) |
| Diaminophenoxazinfarbstoffe | -NR2 | -NR2 | .svg.png) Basic Blue 12 (C.I. 51180) |
| Aminohydroxyphenoxazinfarbstoffe | -NR2 | -OH |  Mordant Blue 14[S 2] |
| Dihydroxyphenoxazinfarbstoffe | - | -OH | 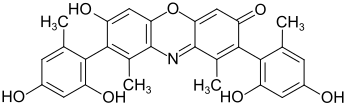 Hydroxyorcein[16] |
| R = H, Alkyl. Aryl | |||
Synthese
Die Phenoxazinfarbstoffe werden typischerweise durch Umsetzung von Nitrosodialkylaminen oder Nitrosodialkylphenolen mit aromatischen Aminen, bzw. Aminophenolen synthetisiert. Die Nitrosoverbindungen erhält man wiederum durch Nitrosierung von N,N-Dialkylanilinen mit Natriumnitrit.
So wird bei der Herstellung von Basic Blue 6 zunächst N,N-Dimethylanilin mit Natriumnitrit und Salzsäure in der Kälte zum N,N-Dimethyl-4-nitrosoanilin umgesetzt. Bei erhöhter Temperatur erfolgt dann ohne Zwischenisolierung der Nitrosoverbindung in einer ethanolischen Lösung die Umsetzung mit 2-Naphthol in Gegenwart von Zinkchlorid zum Farbstoff.[17]
Triphendioxazinfarbstoffe
Insbesondere als Textilfarbstoffe für Baumwollfasern sind die Triphendioxazinfarbstoffe, mitunter auch nur als Dioxazinfarbstoffe bezeichnet, von Bedeutung. Diese erhält man durch die Umsetzung von aromatischen Aminen mit Chloranil.
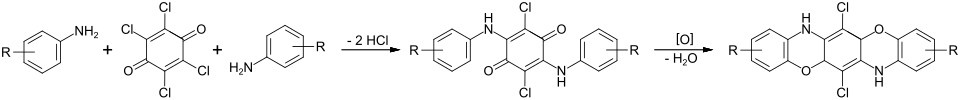
Dabei erfolgt zunächst die Kondensation der beiden Komponenten in Gegenwart eines säurebindenden Mittels. Anschließend werden die beiden Oxazinrige in konzentrierter Schwefelsäure oxidativ geschlossen.[18]
Direct Blue 106[S 3] ist ein typischer Vertreter der Triphendioxazinfarbstoffe aus der Gruppe der Direktfarbstoffe.[19]
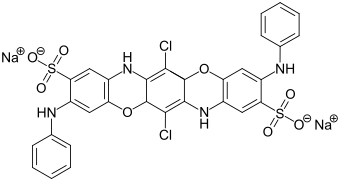
Phenothiazinfarbstoffe
Phenothiazinfarbstoffe wie beispielsweise Methylenblau (C.I. Basic Blue 9) wurden ursprünglich in der Seidenfärberei eingesetzt, wurden jedoch wegen ihrer geringen Lichtechtheit von anderen Farbstoffen verdrängt. Da die Lichtechtheit auf Acrylfasern deutlich besser ist, erlebten sie als Textilfarbstoffe eine Renaissance.[20] Eine weitere Anwendung ist die Verwendung bei histologischen Färbungen, wie beispielsweise der Toluidinblau-Färbung mit dem Diaminophenothiazinfarbstoff Toluidinblau (C.I. Basic Blue 17).[1]
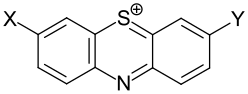
| Beispiele für Phenothiazinfarbstoffe | |||
|---|---|---|---|
| |||
| Gruppe | X | Y | Beispiel |
| Diaminophenothiazinfarbstoffe | -NR2 | -NR2 | .svg.png) Basic Blue 9 (C.I. 52015) |
| Aminohydroxyphenothiazinfarbstoffe | -NR2 | -OH |  Mordant Blue 51[Anm. 2] (C.I. 52055) |
Synthese
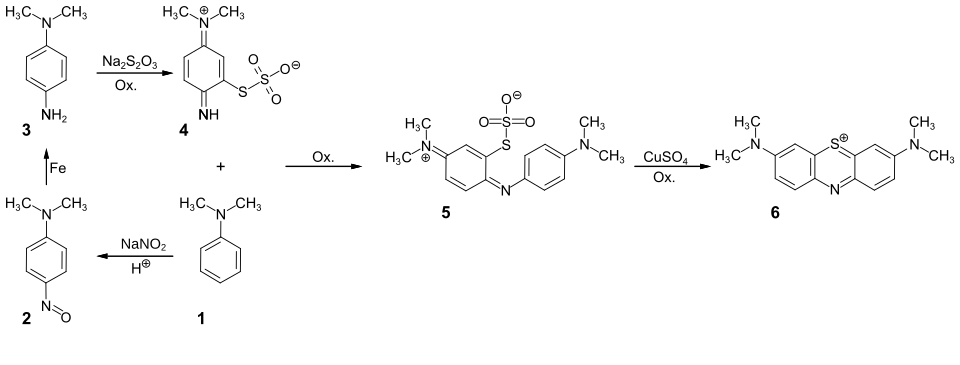
Bei der Synthese von Phenothiazinfarbstoffen wird das heterocyclische Schwefelatom durch Addition an eine chinoide Zwischenstufe eingeführt. Dabei wird bei den industriellen Herstellverfahren neben Schwefelwasserstoff oder Sulfiden insbesondere Natriumthiosulfat verwendet.[1]
So wird beispielsweise bei der Herstellung von Basic Blue 9 zunächst N,N-Dimethylanilin (1) nitrosiert. N,N-Dimethyl-4-nitrosoanilin (2) wird dann mit Eisen zum Dimethylphenylendiamin (3) reduziert und dieses ohne Zwischenisolierung mit Natriumthiosulfat, Schwefelsäure und Natriumdichromat umgesetzt. Aus der chinoiden Thiosulfonsäurezwischenstufe 4 bildet sich durch weitere Zugabe von N,N-Dimethylanilin und Natriumdichromat die Indaminthiosulfonsäure 5, die mit Kupfersulfat und Natriumdichromat oxidativ zum Endprodukt 6 cyclisiert wird.[21]
Einzelnachweise
- ↑ a b c d e f g h Horst Berneth: Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons, Ltd, 2008, ISBN 978-3-527-30673-2, Azine Dyes, doi:10.1002/14356007.a03_213.pub3.
- ↑ Eintrag zu Phenoxazin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. April 2025.
- ↑ Eintrag zu Phenothiazin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. April 2025.
- ↑ Eintrag zu Azin-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. April 2025.
- ↑ Otto Meth-Cohn, Mandy Smith: What did W. H. Perkin actually make when he oxidised aniline to obtain mauveine? In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 1, 1994, S. 5–7, doi:10.1039/P19940000005.
- ↑ Norbert Welsch, Claus Chr. Liebmann: Farben: Natur, Technik, Kunst. 2. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1563-2, S. 206 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Meldola: Einwirkung von Nitrosodimethylanilin auf Phenole, welche nicht die Methylgruppe enthalten. In: Ber. Dtsch. Chem. Ges. Band 12, Nr. 2, 1879, S. 2065–2066, doi:10.1002/cber.187901202221.
- ↑ Paul Seidel: Triphendioxazin als Oxydationsproduct des Orthoamidophenols. In: Berichte der deutschen chemischen Gesellschaft. Band 23, Nr. 1, 1890, S. 182–189, doi:10.1002/cber.18900230136.
- ↑ G. Fischer: Ueber Einen neuen Farbstoff aus Orthoamidophenol. In: Journal für Praktische Chemie. Band 19, Nr. 1, 1879, S. 317–321, doi:10.1002/prac.18790190129.
- ↑ Patent DE517194: Verfahren zur Darstellung von Farbstoffen. Angemeldet am 7. Juni 1928, veröffentlicht am 4. Februar 1931, Anmelder: IG Farbenindustrie, Erfinder: Georg Kränzlein, Heinrich Greune, Mx Thiele.
- ↑ F. Kehrmann, K. L. Stern: Konstitution der Rosindone und Iso-rosindone. In: Berichte der deutschen chemischen Gesellschaft. Band 41, Nr. 1, 1908, S. 12–17, doi:10.1002/cber.19080410104.
- ↑ J. F. Corbett: The Mechanism of Formation of Phenosafranine Dyes. In: Journal of the Society of Dyers and Colourists. Band 88, Nr. 12, 1972, S. 438–443, doi:10.1111/j.1478-4408.1972.tb03054.x.
- ↑ Patent DE1031272: Verfahren zum Färben und Bedrucken von Fasern aus Polyacrylnitril. Angemeldet am 17. April 1954, veröffentlicht am 4. Juni 1958, Anmelder: Ciba-Geigy AG, Erfinder: Jacques Wegmann, Paul Rhyner, Heinrich Zollinger, Hans Wilhelm Liechti.
- ↑ Karl-Heinz Drexhage: Dye Lasers. In: Topics in Applied Physics. Springer-Verlag, Berlin 1973, Structure and Properties of Laser Dyes, S. 172 ff., doi:10.1007/978-3-662-11579-4.
- ↑ Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3, S. 119 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans Musso, Uwe Ingomar Záhorszky, Hermann Beecken, Ellen-Marie Gottschalk, Horst Krämer: Über Orceinfarbstoffe, XXV. Bildungsmechanismus und Synthese von Orceinfarbstoffen. In: Chemische Berichte. Band 98, Nr. 12, 1965, S. 3964–3980, doi:10.1002/cber.19650981224.
- ↑ Patent DE1569605: Verfahren zur Herstellung von basischen Oxazinfarbstoffen. Angemeldet am 25. August 1967, veröffentlicht am 2. Juli 1970, Anmelder: Farbwerke Hoechst AG, Erfinder: Norbert Ottawa, Gustav Schäfer.
- ↑ Patent DE515194: Verfahren zur Darstellung von Farbstoffen. Angemeldet am 7. Juni 1928, veröffentlicht am 4. Februar 1931, Anmelder: I.G. Farbenindustrie Akt. Ges., Erfinder: Georg Kränzlein, Heinrich Greune, Max Thiele.
- ↑ Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-527-30426-6, S. 112 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ingo Klöckl: Chemie der Farbmittel. In der Malerei. De Gruyter, Berlin, München, Boston 2015, ISBN 978-3-11-037453-7, S. 319, doi:10.1515/9783110374537.
- ↑ N. Hughes: Rodd's Chemistry of Carbon Compounds. 2. Auflage. Elsevier, Amsterdam 1964, ISBN 978-0-444-53345-6, Chapter 45 - Phenazine, Oxazine, Thiazine and Sulphur Dyes, S. 428, doi:10.1016/b978-044453345-6.50793-8.
Anmerkungen
- ↑ In der Literatur werden teilweise nur Farbstoffe mit einem Phenazin- oder Chinoxalin-Strukturelement den Azinfarbstoffen zugeordnet.
- ↑ a b Die deprotonierte Verbindung liegt bevorzugt in der tautomeren Keto-Form vor.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-(Diethylamino)-7-hydroxy-5-phenylphenazin-5-ium: CAS-Nr.: 97849-64-4, EG-Nr.: 619-296-3, ECHA-InfoCard: 100.112.449, PubChem: 136338835, ChemSpider: 23354010, Wikidata: Q134077849.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Mordant Blue 14: CAS-Nr.: 1562-90-9, EG-Nr.: 216-346-2, ECHA-InfoCard: 100.014.861, ChemSpider: 10807165, Wikidata: Q27160109.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Direct Blue 106: CAS-Nr.: 6527-70-4, EG-Nr.: 229-417-8, ECHA-InfoCard: 100.026.744, PubChem: 81014, ChemSpider: 4788805, Wikidata: Q72469548.