Rosindon
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
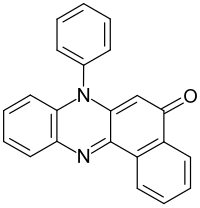
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Rosindon | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C22H14N2O | ||||||||||||
| Kurzbeschreibung |
mennigrotes Kristallpulver[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 322,4 g·mol−1 | ||||||||||||
| Schmelzpunkt |
259 °C[1] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Rosindon ist eine chemische Verbindung aus der Gruppe der Azinfarbstoffe.
Geschichte
Die Verbindung wurde erstmals 1890 von Otto Fischer und Eduard Hepp beschrieben. Die Bezeichnung Rosindon wurde gewählt, da sie aus Rosindulin synthetisiert wurde und der Sauerstoff im Molekül als Chinon vorliegt.[4]
Darstellung
Rosindon entsteht durch Erhitzen von Rosindulin und Rosindulin-Derivaten mit konzentrierter Salzsäure.[1]
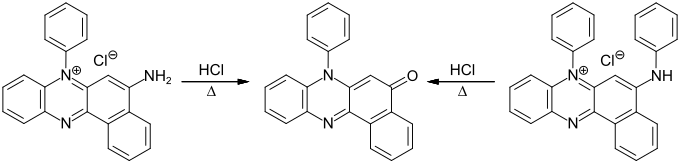
Eine alternative Synthesemethode ist die Umsetzung von N-Phenyl-o-phenylendiamin mit 2-Hydroxy-1,4-naphthochinon in Gegenwart von Essigsäure.[5][2]
.svg.png)
Struktur
Für Rosindon lassen sich zwei mesomere Grenzstrukturen formulieren – einerseits eine Benzophenazoninon-Grenzstruktur 1 und andererseits als Betain die Benzophenazoniumolat-Grenzstruktur 2. Während Fischer und Hepp die Carbonyl-Struktur bevorzugten, wurde von Friedrich Kehrmann in einer Veröffentlichung von 1908 die Betain-Struktur präferiert.[6] Die Röntgenstrukturanalyse von Einkristallen die aus einer Lösung der Verbindung Chloroform/Hexan erhalten wurden, zeigen, dass die C-O-Bindungslänge mit 1,241 Å besser zu einer Doppelbindung passt. Ebenso sprechen die anderen Bindungslängen im Molekül gegen einen nennenswerten Anteil der Betain-Grenzstruktur im Grundzustand.[2]
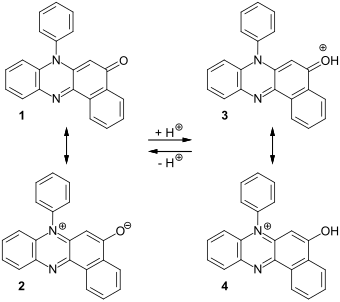
Analog kann man für die protonierte Verbindung zwei mesomere Grenzstrukturen mit einer protonierten Carbonylgruppe (Grenzstruktur 3), bzw. mit einer Hydroxygruppe (Grenzstruktur 4) formulieren.
Das Benzophenazon-Strukturelement ist planar und die N-Phenylgruppe ist mit einem Winkel von 85° aus der Ebene herausgedreht.[2]
Eigenschaften
Durch Sulfierung von Rosindon (1) mit rauchender Schwefelsäure – 1890 von der Chemischen Fabrik Kalle & Co. patentiert[7] – sind Säurefarbstoffe wie beispielsweise C.I. Acid Orange 15 (2) zugänglich.[8] Da die Sulfonierung mit Schwefelsäure ein schwer zu trennendes und identifizierbares Produktgemisch liefert, wurde versucht die Sulfonsäuregruppe über eine Chlorsulfonierung mit Chlorsulfonsäure einzuführen. Dabei wurde jedoch mit geringer Ausbeute als Hauptprodukt das in der 6-Position mit Chlor substituierte Produkt 6-Chlor-7‐phenylbenzo[a]phenazin‐5(7H)‐on (3) erhalten.[9]

Mit Nitriersäure erhält man das 6-Nitro-Derivat (4) des Rosindons. Dieses kann mit Zinn(II)-chlorid zur Aminoverbindung (5) reduziert werden. Durch die Umsetzung von Rosindon mit Trimethylsilylacetylen und Butyllithium in Tetrahydrofuran erhält man nach der Aufarbeitung mit Wasser/Methanol das mit einer Acetylengruppe substituiertes Dihydrobenzobhenazinon-derivat (6).[9]
Rosindon geht bei der Reduktion in einer Zinkstaubdestillation in Benzo[a]phenazin über.[1][4]

Verwendung
Rosindon und Rosindon-Derivate können als Redoxindikator,[8] bei histologischen Färbungen oder bei der Metallionendetektion Verwendung finden.[9]
Einzelnachweise
- ↑ a b c d e Rudolf Nietzki: Chemie der organischen Farbstoffe. Julius Springer Verlag, 1906, ISBN 978-3-642-90202-4, S. 256 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 23. Juli 2025]).
- ↑ a b c d Dumitru Sirbu, Rebecca Wales, David R. Geary, Paul G. Waddell, Andrew C. Benniston: Rosindone revisited: a computational and photophysical study of 7-phenylbenzo[a] phenazine-5(7H)-one (PBP). In: Photochemical & Photobiological Sciences. Band 18, Nr. 1, 2019, S. 140–147, doi:10.1039/c8pp00279g.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Otto Fischer, Eduard Hepp: Studien in der Indulingruppe. In: Justus Liebigs Annalen der Chemie. Band 256, Nr. 3, 1890, S. 233–263, doi:10.1002/jlac.18902560302.
- ↑ Fr. Kehrmann, J. Messinger: Ueber Beziehungen der Eurhodine zu den Indulinen und Saffraninen. In: Berichte der deutschen chemischen Gesellschaft. Band 24, Nr. 1, 1891, S. 584–592, doi:10.1002/cber.189102401108.
- ↑ F. Kehrmann, K. L. Stern: Konstitution der Rosindone und Iso-rosindone. In: Berichte der deutschen chemischen Gesellschaft. Band 41, Nr. 1, 1908, S. 12–17, doi:10.1002/cber.19080410104.
- ↑ Patent DE55227: Verfahren zur Darstellung von Rosindonsulfonsäuren. Angemeldet am 23. Mai 1890, veröffentlicht am 9. Januar 1891, Anmelder: Kalle & Co. in Biebrich a. Rh..
- ↑ a b L. Michaelis: ROSINDULINE AS OXIDATION-REDUCTION INDICATOR. In: Journal of Biological Chemistry. Band 91, Nr. 1, 1. April 1931, S. 369, doi:10.1016/S0021-9258(18)76620-9 (englisch).
- ↑ a b c Ben Clarke, Rebecca Wales, Joshua Oates, Paul G. Waddell, Andrew C. Benniston: Selected Rosindone Derivatives: Synthesis, Structural Characterization, and Photophysical Studies. In: ChemistrySelect. Band 9, Nr. 43, 2024, doi:10.1002/slct.202403989 (core.ac.uk [PDF; abgerufen am 23. Juli 2025]).