Hadarchaeota
| „Candidatus Hadarchaeota“ | ||||||||
|---|---|---|---|---|---|---|---|---|

Visualisierung von Hadarchaeota-Zellen in einem mikrobiellen Aggregat (Überlagerung von drei Fluoreszenzkanälen) | ||||||||
| Systematik | ||||||||
| ||||||||
| Wissenschaftlicher Name | ||||||||
| „Candidatus Hadarchaeota“ | ||||||||
| Chuvochina et al. 2019 |
„Candidatus Hadarchaeota“ ist ein 2019/2023 von Maria Chuvochina, Christian Rinke, Donovan Parks, Philip Hugenholtz et al. bezeichnetes Kandidatenphylum von Archaeen im Reich Methanobacteriati mit Typusklasse „Ca. Hadarchaeia“.[1]
„Candidatus Hadesarchaeota“ ist ein 2017 von Violette Da Cunha, Morgan Gaia, Patrick Forterre et al. bezeichnetes Kandidatenphylum von Archaeen (ebenfalls) aus dem Reich Methanobacteriati mit Typusklasse Klasse „Ca. Hadesarchaea“,[1] die früher als South-African Gold Mine Miscellaneous Euryarchaeal Group (SAGMEG) bezeichnet wurde. Eine weitere veraltete Bezeichnung für diese Gruppe ist „Stygia“ (s. u.).[2]
Beide Archaeenphyla sind in der maßgeblichen List of Prokaryotic names with Standing in Nomenclature (LPSN) trotz der Namensähnlichkeit getrennt und nicht als Synonyme gelistet.[1][3]
Die Genome Taxonomy Database (GTDB) kennt von beiden Phyla nur Hadarchaeota. Die in der LPSN unter „Ca. Hadesarchaeota“ gelisteten Stämme bzw. DNA-Sequenzen (MAGs) sind der GTDB entweder nicht bekannt oder haben eine für die Berechnung unzureichende Qualität.[4]
Die Taxonomie des National Center for Biotechnology Information (NCBI) kennt ebenfalls von den beiden Phyla nur „Ca. Hadarchaeota“, synonymisiert aber auf Klassenebene die „Hadesarchaea“ mit „Ca. Hadarchaeia“.[5] In diesem Artikel werden die Typusklassen der beiden Phyla entsprechend der NCBI-Taxonomie als synonym betrachtet, was dann in Konsequenz auch für die beiden Phyla selbst gelten muss.
Dies wird unterstützt durch die übereinstimmende Lebensweise: Es handelt sich um thermophiler Mikroorganismen, die in tiefen Minen, heißen Quellen, marinen Sedimenten und anderen Umgebungen tief im Boden gefunden wurden.[6][7][8][9][10]
Weitere Veröffentlichungen zeigen im Vergleich, dass einzelne Stämme (korrekter: MAGs oder andere Gensequenzen) Spezies, Gattungen usw., mit unterschiedlichen Bezeichnungen zugeordnet wurden, sodass sich weitere Synonymien ergeben. Insbesondere sind das:
- Phylum „Ca. Hadarchaeota“ ≡ „Ca. Hadesarchaeota“ (Folge der Synonymie der Typusklassen nach der NCBI-Taxonomie)[5][3]
- Klasse „Ca. Hadarchaeia“ ≡ „Ca. Hadesarchaea“ (synonym nach der NCBI-Taxonomie)[5]
- Ordnung „Ca. Hadarchaeales“ ≡ „Ca. Hadesarchaeales“
- Familie „Ca. Cerberiarchaeaceae“ ≡ f__WYZ-LMO6 ≡ „Ca. Hadesarchaeaceae“ (gemeinsame Stämme JZ-1 bin_103 und JZ-2 bin 199)[11][4][3]
- Gattung „Ca. Melinoarchaeum“ ≡ WYZ-LMO6 ≡ „Ca. Hadesarchaeum“ (gemeinsamer Stamm JZ-2 bin 199)[11][4][3]
- Eine Synonymie der Spezies „Ca. Hadesarchaeum tengchongensis“ (Stamm JZ-2 bin_199) mit „Ca. Melinoarchaeum fermentans“ (Stamm DL9YTT1) ist wegen der phylogenetischen Nähe der beiden Stämme[11] naheliegend, aber nicht zwingend.
Diese Vorgehensweise ist auch verträglich mit David Benito Merino et al. (2024)[12] und Hua et al. (2019)[13] – wenn nicht gar erforderlich.
Forschungsmethoden
Die Kultivierung dieser Archaeen ist äußerst schwierig,[14] so dass in der Forschung heute in großem Ausmaß auf kultivierungsunabhängige Methoden wie die Metagenomik zurückgegriffen wird.
Habitat und Stoffwechsel
SAGMEG

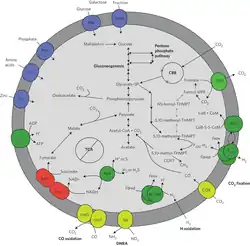
Die ersten dieser Archaeen (SAGMEG, Kandidatenklasse Hadarchaeia oder Hadesarchaea) wurden in einer Goldmine in Südafrika entdeckt. Dort leben sie in einer Tiefe von etwa 3 km ohne Sauerstoff und Licht.[6][15] Später wurden weitere auch im Mündungsgebiet (Ästuar) des White Oak River (WOR)[16][17] in North Carolina und im Lower Culex Basin (LCB) des Yellowstone-Nationalparks gefunden.[6] Diese Habitate haben eine Temperatur von etwa 70 °C und sind stark alkalisch.[6] Nach einer 2019 veröffentlichten Untersuchung phylogenetischer Markergene in Böden alter Bergbaugebiete im östlichen Harzgebiet könnte es weitere Vorkommen auch dort geben.[18]
Diese Archaeen wurden auch in Meeresumgebungen gefunden. Zu diesen Gebieten gehören unter anderem Kaltquellsysteme (cold seep systems) im Südchinesischen Meer zwischen Vietnam, China und Luzon (Philippinen), wo sie als dominierendes Mitglied der dortigen Archaeen-Gemeinschaft identifiziert wurden. In den gashydrathaltigen Sedimenten bei diesen Kaltquellen spielen sie eine wichtige Rolle im biogeochemischen Kreislauf.[19] Hadesarchaea wurden auch unter dem Meeresboden im Guaymas-Becken und vor der Küste des mexikanischen Bundesstaates Sonora (Sonora Margin) im Golf von Kalifornien gefunden.[20][21][22]
Hadesarchaea wurden außer in diesen geologischen Habitaten (Meeressedimente, Minen und heißen Quellen) auch im Darmmikrobiom bestimmter Fischarten nachgewiesen. Ein Beispiel ist der in den indischen Bundesstaaten Assam, Bihar und Westbengalen heimische Süßwasser-Kugelfisch (Tetraodon cutcutia [Leiodon cutcutia]), wo Hadesarchaea die zweithäufigste Archaeen-Gruppe in dessen Mikrobiom darstellen. In ähnlicher Häufigkeit wurden sie auch im Darm von fleischfressenden Lachsen und pflanzenfressenden Graskarpfen gefunden. Trotz dieser Häufigkeit im Mikrobiom vieler Fische ist nicht vollständig bekannt, wie sie die Gesundheit und die trophische Ebene dieser Fische beeinflussen.[23]
Im Jahr 2016 veröffentlichten Brett J. Baker, Thijs J. G. Ettema et al. eine Studie, in der sie die Identifizierung einer neuen Kandidatenklasse „Hadesarchaea“ innerhalb des heutigen Archaeen-Reichs Methanobacteriati (früher „Euryarchaeida“ oder „Euryarchaeota“ s. l.) per Metagenomik aus Proben vom Ästuar des White Oak River[17][16] (Hadesarchaea archaeon DG-33[24]) und vom Lower Culex Basin im Yellowstone-Nationalpark (Ca. Hadarchaeum yellowstonense YNP_45)[25] bekannt gaben.[6] Bei 2018/2020 an der Universität Hongkong vorgenommenen Datenanalysen von bereits 2012 aus dem Obsidian Pool (ebenfalls im Yellowstone-Nationalpark) entnommenen Proben konnte ein weiterer Stamm SpSt-756 der Spezies „Ca. Hadarchaeum yellowstonense“ aus dem Lower Culex Basin identifiziert werden.[26]
Aufgrund ihres kleinen Genoms wird angenommen, dass die Genome der Hadesarchaea – möglicherweise als Folge von Nährstoffmangel – einer Genomverschlankung (genome streamlining) unterlagen.[6]
Hadesarchaea sind unter den bekannten Archaea insofern einzigartig, als sie Kohlenmonoxid und Wasserstoff oxidieren können, und so im tiefen Boden Kohlenstoff fixieren können (wobei Wasser als Nebenprodukt entsteht). Aus den metagenomisch assemblierten Genom-Daten (MAGs) geht hervor, dass sie Gene besitzen, die mit dem Wood-Ljungdahl-Kohlenstofffixierungsweg, der Methanogenese und dem Alkanstoffwechsel in Verbindung stehen.[13][27] Darüber hinaus wurde berichtet, dass die Genome von Hadesarchaea Gene enthalten, die es ihnen ermöglichen, Zucker und Aminosäuren in einem heterotrophen Lebensstil zu verstoffwechseln und eine dissimilatorische Nitrit-Reduktion zu Ammonium durchzuführen.[6][8] Die Forschungsergebnisse deuten darauf hin, dass diese Organismen an bedeutenden geochemischen Prozessen beteiligt sind.[6][8]
Jolien van Hooff, Laura Eme et al. hatten, wie im Juli 2025 veröffentlicht, die Verteilung von Condensinen analysiert, darunter SMC-Proteine,[A. 1] Kleisin und Kite-Paraloge.[A. 2] Wie sich zeigte, beherbergen viele Archaeen zwei vollständige SMC-Komplexe. Eine genaue Untersuchung bei einigen repräsentativen Arten zeigte, dass die diese Paraloge kodierenden Sequenzen im Genom in unterschiedlichen Operons organisiert sind, die jeweils alle drei SMC-Untereinheiten kodieren. Die meisten Arten, die beide Komplexe besitzen, gehören zu den Reichen Thermoproteati und Promethearchaeati (TACK- respektive Asgard-Supergruppe; zusammen Proteoarchaea); dennoch tragen sie auch einige Vertreter des Reichs Methanobacteriati (Euryarchaeida oder Euryarchaeota s. l.), darunter befinden sich insbesondere Hadesarchaeota. Da sich die Euryarchaeida noch früher von den TACK- und Asgard-Archaeen abgespalten haben, könnte dies auf einen noch älteren Ursprung dieser beiden Komplexe hindeuten. Allerdings sind die phylogenetischen Beziehungen der Phyla dieses Reichs derzeit (Juli 2025) noch immer in der Diskussion.[28]
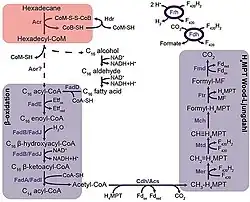
Von Thermophilen Hadarchaeota, darunter insbesondere die Gattung „Ca. Melinoarchaeum“, ist bekannt, dass sie auf langkettigen Alkanen (wie Hexadecan) wachsen. Sie aktivieren dabei zunächst die Alkane über Alkyl-Coenzym-M-Reduktasen (ACRs, vgl. Methyl-Coenzym-M-Reduktase, MCR). Die aktivierten Alkane werden anschließend, wahrscheinlich per β-Oxidation, zu kleinen Molekülen wie Kohlendioxid (CO2), Wasserstoff (G2) und Acetat (H3COO−) abgebaut. Dieser Prozess findet in Syntrophie mit Methanogenen statt, die den von „Ca. Melinoarchaeum“ erzeugten niedermolekularen Produkte (wie den Wasserstoff) als Substrat nutzen, um Methan zu produzieren. Unter den in dieser syntrophen Beziehung lebenden Methanogenen wurden Vertreter der Gattungen Methanothermobacter (hydrogenotroph, d. h. Wasserstoff verwertend) und Methanothrix (acetoklastisch, d. h. Essigsäure/Acetat-spaltendend) ausgemacht. Die syntrophe Beziehung ist wahrscheinlich obligat, was bedeutet, dass „Ca. Melinoarchaeum“ und die vergesellschafteten Methanogenen für ihr Wachstum und Überleben voneinander abhängig sind. Für eine mögliche Kultivierung bedeutet das, dass man „Ca. Melinoarchaeum“ (wie vermutlich viele andere Vertreter des Phylums) nur in Co-Kultivierung mit anderen Mikroorganismen halten kann.[11]

Eine weitere Besonderheit der Hadesarchaea-Archaeen ist ein extrem häufiges Vorkommen von G-Quadruplexen im ihrem Genom (G4-DNA), wie Václav Brázda, Patrick Forterre et&al. (2020) zeigten. Bei dem vermutlich ebenfalls zur Gattung „Ca. Melinoarchaeum“ gehörenden Isolat WYZ-LMO6 (s. u.) ist beispielsweise mehr als 50 % des Genoms potenzieller Teil eines G4-Motivs.[29]
Wie von Timothy M. Ghaly (2022) aufgezeigt, gibt es im Genom des zur Kandidatenfamilie Hadarchaeaceae gehörenden Isolats DG-33 (GTDB-Spezies DG-33 sp001515185) Integrons.[30]
MSBL1
Die Gruppe MSBL1 (MSBL-1, Kandidatenklasse Persephonarchaeia, Persephonarchaea oder Persephonearchaea) ist eine bisher (Stand Mitte August 2025) unkultivierte Archaeenlinie, die in tiefen hypersalinen anoxischen Becken (deep hyper-saline anoxic basins, DHABs) des Mittelmeers, des Roten Meeres und des Golfs von Mexiko reichlich vorhanden und weit verbreitet ist. Sie wurde mittels phylogenetischer Untersuchungen auf Grundlage der ribosomalen RNA (rRNA) sowie weiterer konservierter Gene identifiziert. Die Analyse von Mwirichia et al. (2016) zeigte, dass diese Archaeen Glukose über den Embden-Meyerhof-Parnas-Weg abbauen können. In Abwesenheit von organischem Kohlenstoff kann Kohlendioxid jedoch über die Ribulose-Biphosphat-Carboxylase (RuBisCO), den Wood-Ljungdahl-Weg oder den reduktiven Citratzyklus (reduktiver TCA-Zyklus, von englisch reductive tricarboxylic acid cycle) gebunden werden.[31]
16S-rRNA-Sequenzdaten dieser Gruppe wurden auch in anderen Umgebungen gefunden, darunter:[31]
- aus dem anoxischen Hypolimnion des flachen, hypersalinen Birkat asch-Schams (englisch Solar Lake) etwas südlich von Eilat auf der Sinai-Halbinsel in Ägypten,
- in Sedimenten des ebenfalls hypersalinen Chaka-Sees (茶卡盐湖 Chákǎ Yánhú[32][33]) in China,[34]
- aus einer Meerwassersaline mit mehreren Becken im Süden der Insel Mallorca und
- per Metagenomik in einem hypersalinen See in Kenia (Magadisee, englisch Lake Magadi[35]).
Die Aminosäure Pyrrolysin (Pyl) wurde 2002 als 22. proteinogene Aminosäure identifiziert (Hao et al., 2002; Srinivasan et al., 2002). Aus biochemischer Sicht ist Pyrrolysin eine typische L-Lysin-Aminosäure, an deren Seitenkette über eine Amidbindung ein Pyrrolring angebunden ist. Die Zucker fermentierenden Archaeen der Gruppe MSBL1 („Persephonarchaea“) aus den hypersalinen Tiefen des Roten Meeres verfügen über einen vollständigen Satz von Genen für die Pyl-Synthese sowie mtmB-, mtbB- und mttB-Gene für Mono-, Di- und Trimethylamin-Methyltransferasen.[36][37]
B88-G9
Das Isolat (bzw. die Genomsequenz) B88_G9 stammt aus einer Probe, die 2008 beim Tauchgang 4571 des Tiefsee-U-Boots Alvin vom Hydrothermal-Schlot Vent 2 im Guaymas-Becken (Golf von Kalifornien) eingesammelt wurde (G9 steht für Guay[mas]9).[38] Das Isolat wird von der NCBI-Taxonomie der Klasse Thermococci der Methanobacteriota („Euryarchaeota“ s. s.) zugeordnet,[39] von der GTDB aber in eine eigene Klasse (provisorische Bezeichnung c__B88-G9) der Hadarchaeota gestellt.[40]
Phylogenie
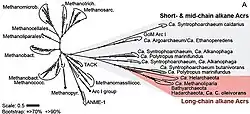
Lange Zeit war die Existenz von Hadesarchaea (oder SAGMEG) und ihre charakteristische phylogenetische Position im Stammbaum des Lebens nur aufgrund der Sequenzierung einzelner Gene vermutet worden. Im Jahr 2016 gelang es Wissenschaftlern mithilfe der metagenomischen Schrotschuss-Sequenzierung (shotgun sequencing), mehrere nahezu vollständige Genome dieser Archaeen zu assemblieren.[6] Es zeigte sich, dass das Genom der Hadesarchaea eine Größe von etwa 1,5 Megabasenpaaren (Mbp) hat,[6] was etwa 0,5 Mbp kleiner ist als das der meisten bis dahin bekannten Archaeen.[6] Zwar konnten diese Archaea bisher (Stand 2025) im Labor nicht erfolgreich kultiviert werden, ihre metabolischen Eigenschaften wurden daher aus den genomischen Rekonstruktionen abgeleitet.[6] Hadesarchaea könnten sich aufgrund der genetischen Ähnlichkeit mit anderen methanogenen Organismen zusammen mit diesen aus einem methanogenen Vorfahren entwickelt haben.[41]
Systematik
Die Verwandtschaftsgruppe (Klade) aus der Kandidatenklasse „Ca. Hadarchaeia“ (synonym: „Ca. Hadesarchaea“, früher SAGMEG)[5] zusammen mit nahe verwandten, ebenfalls aufgrund von Metagenomik-Daten vorgeschlagenen Gruppen wird als Kandidatenphylum „Ca. Hadarchaeota“ bzw. „Ca. Hadesarchaeota“ bezeichnet. Sie ist Teil des Archaeen-Reichs Methanobacteriati (früher als „Euryarchaeida“ bzw. vor Einführung der taxonomischen Rangstufe Reich für Bakterien und Archaeen auch als Superphylum „Euryarchaeota“ s. l. bezeichnet).
Für die Mediterranean Seafloor Brine Lake Group 1 (MSBL-1) als Schwesterklasse von „Ca. Hadesarchaea“ (SAGMEG) schlugen Adam et al. 2017 die Bezeichnung „Ca. Persephonarchaea“ vor. Für die aus beiden Klassen bestehende Klade innerhalb der Euryarchaeota s. l. (d. h. Methanobacteriati) schlug das Team die Bezeichnung „Stygia“ vor, dieser Name wird daher als ein Synonym für das Phylum verstanden.[42][2][43][29]
Die unten wiedergegebene Liste (Stand Mitte August 2025) folgt in erster Linie der Systematik der LPSN. Die in der LPSN vorgenommene Trennung von „Ca. Hadarchaeota“ und „Ca. Hadesarchaeota“ hat sich insbesondere aufgrund neuerer Veröffentlichungen, insbesondere Yu et al. (2024),[11] als undurchführbar erwiesen. Es werden daher die oben angenommenen Synonymien zugrunde gelegt. Die Taxonomie der LPSN ist dennoch transparent dargestellt, da sie beiden LPSN-Zweige „Ca. Hadarchaeota“[1] und „Ca. Hadesarchaeota“[3] unterschiedlich referenziert sind.
Der Stamm JZ-1 bin_103 ist nach der LPSN der Referenzstamm der Spezies „Ca. Methanourarchaeum thermotelluricum“ („Ca. Hadesarchaeaceae“). Gemäß der GTDB gehört dieser Stamm zur Spezies „Panguiarchaeum symbiosum“ (Panguiarchaeales, ?Korarchaeia), neben deren Referenzstamm JZ-1.bin_83ᵀ.[A. 3][3][4]
Leider ist für die Spezies „Ca. Cerberiarchaeum oleivorans“ (Familie „Ca. Cerberiarchaeaceae“) in der LPSN kein Referenzstamm angegeben, bei Yu et al. (2024) ist dieser mit HD70[11](Hexadecane degradation 70 °C[12][A. 4]) benannt. In der Genbank (Nucleotide) zur NCBI-Taxonomie sind zwei Stämme mit dieser Bezeichnung hinterlegt:[5]
- Hadesarchaea archaeon isolate S4B3_HD70
- Hadesarchaea archaeon isolate S4B4_HD70
Der letztere ist in der GTDB der Spezies DYTO01 sp029259175 aus der Familie „Ca. Hadarchaeaceae“ zugeordnet (verschieden von „Ca. Cerberiarchaeaceae“). Der erstere wurde dort der Spezies JAPDJF01 sp029259185 aus de Familie f__WYZ-LMO6 zugeordnet (synonym zu „Ca. Cerberiarchaeaceae“). Diese Familie hat in der GTDB zwei Gattungen, neben JAPDJF01 noch WYZ-LMO6(synonym zu „Ca. Melinoarchaeum“). Eine Synonymie von JAPDJF01 sp029259185 mit „Ca. Cerberiarchaeum oleivorans“ erscheint daher möglich oder wahrscheinlich, wenn Cerberiarchaeum oleivorans HD70[11] angesichts übereinstimmender Autorenschaft und Fundort den Stamm Hadesarchaea archaeon isolate S4B3_HD70 bezeichnet.[A. 5] Weitere mutmaßlichen Synonyme sind daher:
- Gattung: „Ca. Cerberiarchaeum“ ≡ JAPDJF01
- Spezies: „Ca. Cerberiarchaeum oleivorans“ ≡ JAPDJF01 sp029259185 [Hadesarchaea archaeon isolate S4B3_HD70]
- Stamm: HD70[11] ≡ S4B3_HD70[A. 4]
Der bei David Benito Merino et al. (2024) in der Spezies Hadarchaeota sp. 6 gelistete Stamm „Hadarchaeum HD70-2“ kann kein Mitglied der Gattung „Ca. Hadarchaeum“ sein, da „Ca. Hadarchaeum yellowstonense“ (alias Hadarchaeota sp. 17) in einem ganz anderen Zweig des Phylums lokalisiert ist. Stattdessen steht er basal in einer Klade mit den Spezies Hadarchaeota sp. 7 (Stamm SpSt-85) und Spezies Hadarchaeota sp. 8 (Stämme SpSt-591 und SpSt-680),[12] in deren Klade bei Yu et al. (2024) der Stamm DR5 53 9 (lt. GTDB Spezies DYTO01 sp020725895) basal steht.[11][4] Eine Identität von S4B4_HD70 mit HD70-2 ist also möglich oder wahrscheinlich, zumindest scheinen beide der Gattung DYTO01 anzugehören.
.jpg)
- Liste:
Phylum „Candidatus Hadarchaeota“ Chuvochina et al. 2019 bzw. 2023(Lc,N,G)
[„Candidatus Hadesarchaeota“ Da Cunha et al. 2017(Ld)[A. 9]
„Stygia“ Adam et al. 2017(L,A)[44][29]]
- Klasse „Ca. Hadarchaeia“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 10][A. 11]
[„Ca. Hadesarchaea“ Baker et al. 2016(Ld,N),[A. 12]
South-African Goldmine Miscellaneous Euryarchaeal Group(N,A), SAGMEG(N,A)]- Ordnung „Ca. Hadarchaeales“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 10]
[„Ca. Hadesarchaeales“ Hua et al. 2019(Ld,H)[A. 13]]- Familie „Ca. Cerberiarchaeaceae“ Benito Merino et al. 2024(Lc,B,Y)
[„Ca. Hadesarchaeaceae“ corrig. Hua et al. 2019(Ld),[A. 14]
„Ca. Hadesarchaeacaceae“ Hua et al. 2019(Ld),[A. 14]
f__WYZ-LMO6(G,Y)]- Gattung „Ca. Cerberiarchaeum“ Benito Merino et al. 2024(Lc,B) [?syn. JAPDJF01(G)]
- Spezies „Ca. Cerberiarchaeum oleivorans“ Benito Merino et al. 2024(Lc,B,Y) [Hadarchaeota sp. 1(B), ?syn. JAPDJF01 sp029259185(G), ?syn. Hadesarchaea archaeon isolate S4B3_HD70(N)]
- Stamm HD70(Y) ?alias S4B3_HD70(N,G,B)
– Fundort: Guaymas-Becken, Golf von Kalifornien, Mexiko; von Benito Merino, Lipp, Borrel, Boetius & Wegener,(N,B) geprobt(N) bzw. sequenziert(B) im März 2020(N,B)
- Stamm HD70(Y) ?alias S4B3_HD70(N,G,B)
- Spezies „Ca. Cerberiarchaeum oleivorans“ Benito Merino et al. 2024(Lc,B,Y) [Hadarchaeota sp. 1(B), ?syn. JAPDJF01 sp029259185(G), ?syn. Hadesarchaea archaeon isolate S4B3_HD70(N)]
- Gattung JAPDJF01(G) [?syn. „Ca. Cerberiarchaeum“(L,B)]
- Spezies JAPDJF01 sp029259185(G) [Hadesarchaea archaeon isolate S4B3_HD70(N), ?syn. „Ca. Cerberiarchaeum oleivorans“(L,B)]
- Stamm S4B3_HD70(N,G,B)[A. 4] ?alias HD70(Y)
– Fundort: Guaymas-Becken, Golf von Kalifornien, Mexiko; von Benito Merino, Lipp, Borrel, Boetius & Wegener,(N,B) geprobt(N) bzw. sequenziert(B) im März 2020(N,B)
Jinze-Pool, Tengchong
- Stamm S4B3_HD70(N,G,B)[A. 4] ?alias HD70(Y)
- Spezies JAPDJF01 sp029259185(G) [Hadesarchaea archaeon isolate S4B3_HD70(N), ?syn. „Ca. Cerberiarchaeum oleivorans“(L,B)]
- Gattung „Ca. Melinoarchaeum“ Yu et al. 2024(Lc,Y)
[„Ca. Hadesarchaeum“ Hua et al. 2019(Ld,H),[A. 15],
WYZ-LMO6(G,Y)]- Spezies „Ca. Hadesarchaeum tengchongensis“ Hua et al. 2019(Ld,H) [Ca. Hadesararchaeum tengchongensis(H), Unclassified Hadesarchaeota JZ-2 bin_199(H)]
- Spezies „Ca. Melinoarchaeum fermentans“ Yu et al. 2024(Lc,Y)
- Stamm DL9YTT1(Lc,Y) (TC202112_7_001 und TC202112_8_001(Y))
– Fundort: Heiße Quelle, Tengchong, Yunnan, China(Y)
- Stamm DL9YTT1(Lc,Y) (TC202112_7_001 und TC202112_8_001(Y))
- Spezies Hadarchaeota sp. 3(B) [WYZ-LMO6 sp011367165(Go), Hadesarchaea archaeon isolate WYZ-LMO4(N,G,B,Y), Hadesarchaea archaeon isolate WYZ-LMO5(N,G,B,Y)[A. 16]]
- Spezies WYZ-LMO6 sp004347925(G)[A. 17] [Hadesarchaea archaeon isolate WYZ-LMO6(N), Hadesarchaea archaeon isolate LCB024-034(N)]
- Stamm WYZ-LMO6(N,G,B,Y)[A. 18][29]
– Fundort: Shoshone Lake, Yellowstone-Nationalpark, Wyoming, USA(N) - Stamm RSWS5(G)
– Fundort: Yellowstone Lake, Yellowstone-Nationalpark, Wyoming, USA(N) - Stamm LCB024-034(N,B,Y)
– Fundort: Lower Culex Basin, Yellowstone-Nationalpark, Wyoming, USA(N) - Stämme GEMWYZ57; GEMWYZ58(Y)
- Stamm WYZ-LMO6(N,G,B,Y)[A. 18][29]
- Spezies WYZ-LMO6 sp038736355(G) [Ca. Hadarchaeales archaeon isolate DPZ-5_202101_bins_17(N), Ca. Hadarchaeales archaeon isolate ZZQ_201803_bins_104(N), Ca. Hadarchaeales archaeon isolate JZ-1_202007_bins_5(N), Ca. Hadarchaeales archaeon isolate JZ-2_202101_bins_27(N)]
- Stamm DPZ-5_202101_bins_17(N,G)
– Fundort: Pool DPZ-5, Tengchong, Yunnan, China(N) - Stamm ZZQ_201803_bins_104(N,G)
– Fundort: Pool ZZQ, Tengchong, Yunnan, China(N) - Stamm JZ-1_202007_bins_5(N,G)
– Fundort: Pool JinZe-1, Tengchong, Yunnan, China(N) - Stamm JZ-2_202101_bins_27(N,G)
– Fundort: Pool JinZe-2, Tengchong, Yunnan, China(N) - Stämme JZ-1_202101_bins_118; JZ-1_201803_bins_85; JZ-1_201705_bins_45; JZ-1_201907_bins_70; JZ-1_201901_bins_121; GXS_201912_bins_20; GXS_201912_bins_20; JZ-1_201912_bins_114(G)
- Stamm DPZ-5_202101_bins_17(N,G)
- Spezies WYZ-LMO6 sp038851755(G,B) [Hadarchaeota sp. 2(B), Ca. Hadarchaeales archaeon isolate JZ-2_201705_bins_146(N)]
- Spezies WYZ-LMO6 sp938074535(G) [Uncultured archaeon isolate S1_Bin_METABAT__384_1(N)]
- Stamm S1_Bin_METABAT__384_1(N,G)
– Fundort: küstennahes Meerwasser, China
- Stamm S1_Bin_METABAT__384_1(N,G)
- ohne Spezieszuweisung
- Stämme GEMWYZ55; GEMWYZ56(Y)
- Gattung „Ca. Methanourarchaeum“ Hua et al. 2019(Ld,H)[A. 19]
- Gattung „Ca. Cerberiarchaeum“ Benito Merino et al. 2024(Lc,B) [?syn. JAPDJF01(G)]
- Familie „Ca. Hadarchaeaceae“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 10]
- Gattung „Ca. Hadarchaeum“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 20]
- Spezies „Ca. Hadarchaeum yellowstonense“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 20] [Hadesarchaea archaeon YNP_45(N), Hadarchaeota sp. 17(B)]
- Stamm YNP_45(N,G) alias GCA 001515205.2(L,G,B) oder ASM151520v2(Y)
– Fundort: Heiße Quelle im Lower Culex Basin, Yellowstone-Nationalpark, USA - Stamm SpSt-756(B,Y)
– Fundort: Fundort Obsidian Pool[46][47], beides Yellowstone-Nationalpark
- Stamm YNP_45(N,G) alias GCA 001515205.2(L,G,B) oder ASM151520v2(Y)
- Spezies Hadarchaeum sp014361095(G) [Hadesarchaea archaeon isolate MAG-18(N), Hadarchaeota sp. 16(B)]
- Stamm MAG-18(N,G,B)
– Fundort: Dongying, Shengli-Ölfeld (chinesisch 勝利油田, Pinyin Shènglì Yóutián, englisch Shengli Oil Field, wörtlich „Victory Oil Field“), China[48]
- Stamm MAG-18(N,G,B)
- Spezies Hadarchaeum sp038851515(G) [Ca. Hadarchaeum sp. isolate JZ-2_201705_bins_148(N), Ca. Hadarchaeum sp. isolate JZ-3_201901_bins_38(N)]
- Spezies Hadarchaeum sp038871235(G) [Ca. Hadarchaeum sp. isolate KM4338-48(N), Ca. Hadarchaeum sp. isolate DRTY-6_201901_bins_47(N), Ca. Hadarchaeum sp. isolate DRTY-6_201709_bins_4(N), Ca. Hadarchaeum sp. isolate DRTY-6_201705_bins_9(N)]
- Stamm KM4338-48(N) (Referenzstamm nach NCBI-Taxonomie)
– Fundort: terrestrische Thermalquelle, Uson-Caldera, Kamtschatka(N) - Stamm DRTY-6_201901_bins_47(N,G) (Referenzstamm nach GTDB)
– Fundort: Pool DRTY-6 (DiReTiYanQu-6[13]), Tengchong, Yunnan, China(N) - Stämme DRTY-6_201709_bins_4(N,G); DRTY-6_201705_bins_9(N,G); DRTY-6_201803_bins_94(N,G); DRTY-6_201907_bins_27(N,G)
– Fundort: ebenda(N)
- Stamm KM4338-48(N) (Referenzstamm nach NCBI-Taxonomie)
- Spezies „Ca. Hadarchaeum yellowstonense“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 20] [Hadesarchaea archaeon YNP_45(N), Hadarchaeota sp. 17(B)]
- Gattung B75-G9(G)
- Spezies B75-G9 sp003661465(G,B) [Hadesarchaea archaeon isolate B75_G9(N), Hadarchaeota sp. 15(B)]
- Stamm B75_G9(N,G) alias B75 G9(Y)
– Fundort: Guaymas-Becken, Golf von Kalifornien, Mexiko(N) - Stamm HyVt-144 (GCA 011040755.1)(G,B,Y)
- Stamm B75_G9(N,G) alias B75 G9(Y)
- Spezies B75-G9 sp012962055(G,B) [Hadesarchaea archaeon isolate UWMA-0211(N), Hadarchaeota sp. 13(B)]
- Stamm UWMA-0211(N,G,Y)
– Fundort: Mid-Cayman Rise, Kaimangraben, Karibisches Meer, Atlantik(N)
- Stamm UWMA-0211(N,G,Y)
- Spezies B75-G9 sp003661465(G,B) [Hadesarchaea archaeon isolate B75_G9(N), Hadarchaeota sp. 15(B)]
- Gattung CAKZTQ01(G)
- Spezies CAKZTQ01 sp038851365(G) [Ca. Hadarchaeales archaeon isolate JZ-2_201705_bins_157(N)]
- Spezies CAKZTQ01 sp937921735(G) [Uncultured archaeon isolate S1_Bin_MAXBIN__091_sub_1(N)]
- Stamm S1_Bin_MAXBIN__091_sub_1(N,G)
– Fundort: marines Metagenom (Seewasser)(N)
- Stamm S1_Bin_MAXBIN__091_sub_1(N,G)
- Gattung DAOUSU01(G)
- Spezies DAOUSU01 sp030627035(G) [Hadesarchaea archaeon isolate CSMAG_554(N)]
- Stamm CSMAG_554(N,G)
– Fundort: Metagenom aus einer Kaltquelle (cold seep)(N)
- Stamm CSMAG_554(N,G)
- Spezies DAOUSU01 sp030627035(G) [Hadesarchaea archaeon isolate CSMAG_554(N)]
- Gattung DG-33(G)
- Spezies DG-33 sp001515185(G) [Hadesarchaea archaeon DG-33(N), Hadarchaeota sp. 18(B)]
- Stamm DG-33(N,G,Y)[30]
– Fundort: Ästuar des White Oak River, North Carolina(N)[17][16]
- Stamm DG-33(N,G,Y)[30]
- Spezies DG-33 sp004375695(G) [Hadarchaeota sp. 19(B), Hadesarchaea archaeon isolate E44_bin86(N)]
- Stamm E44_bin86(N,G,Y) alias E44 bin86(Y)
– Fundort: Tiefseesediment bei Erdölsickerstellen (Erdölaustritten), Golf von Mexiko(N) - Stamm 1244-C3-H4-B1(G,Y)
– Fundort: Methanhydrat-Meeressediment im Pazifik(N) - Stamm CSMAG_1258(G)
- Stamm E44_bin86(N,G,Y) alias E44 bin86(Y)
- Spezies DG-33 sp023129675(G) [Hadesarchaea archaeon isolate RS_16_21(N), Hadarchaeota sp. 20(B)]
- Stamm RS_16_21(N,G) alias TS 16 21(Y)
– Fundort: Südchinesisches Meer, SW von Taiwan(N) - Stamm CSMAG_1997(G)
– Fundort: Metagenom aus einer Kaltquelle (cold seep)(N)
- Stamm RS_16_21(N,G) alias TS 16 21(Y)
- Spezies DG-33 sp029880065(G) [Hadesarchaea archaeon isolate 8_1_Oct_SF_Bin37(N)]
- Stamm 8_1_Oct_SF_Bin37(N,G)
– Fundort: Carquinez-Straße (Ästuar), Bucht von San Francisco, Kalifornien(N) - Stãmme 8_1_Jan_SF_Bin79; S_237_B15(G)
- Stamm 8_1_Oct_SF_Bin37(N,G)
- Spezies DG-33 sp030601665(G) [Hadesarchaea archaeon isolate CSMAG_1323(N)]
- Stamm CSMAG_1323(N,G)
– Fundort: Metagenom aus einer Kaltquelle (cold seep)(N)
- Stamm CSMAG_1323(N,G)
- Spezies DG-33 sp030601675(G) [Hadesarchaea archaeon isolate CSMAG_1321(N), Hadesarchaea archaeon isolate CSMAG_1305(N)]
- Stamm CSMAG_1321(N,G)
– Fundort: dito(N) - Stamm CSMAG_1305(N,G)
– Fundort: dito(N)
- Stamm CSMAG_1321(N,G)
- Spezies DG-33 sp030615805(G) [Hadesarchaea archaeon isolate CSMAG_2711(N)]
- Stamm CSMAG_2711(N,G)
– Fundort: dito(N)
- Stamm CSMAG_2711(N,G)
- Spezies DG-33 sp030619825(G) [Hadesarchaea archaeon isolate CSMAG_2768(N)]
- Stamm CSMAG_2768(N,G)
– Fundort: dito(N)
- Stamm CSMAG_2768(N,G)
- Spezies DG-33 sp030672285(G) [Hadesarchaea archaeon isolate CSMAG_1141(N)]
- Stamm CSMAG_1141(N,G)
– Fundort: dito(N)
- Stamm CSMAG_1141(N,G)
- Spezies Hadarchaeota sp. 21(B) [Hadesarchaea archaeon B3_Hades(N), Hadesarchaea archaeon isolate E26_bin1(N), Hadesarchaea archaeon isolate E44_bin54][A. 21]
- Stamm B3_Hades(N,B) alias B3 Hades(Y)
– Fundort: Südchinesisches Meer, zw. Hongkong und Taiwan (d. h. SW von Taiwan)(N,G) - Stamm E26_bin1(N,G,B) (GCA_004376755.1)(G,B) alias E26 bin1(Y)
– Fundort: Tiefseesedimente in Verbindung mit Erdölsickerstellen, Golf von Mexiko(N) - Stamm E44_bin54(N,G,B,Y) (GCA_004375795.1)(G,B) alias E26 bin54(Y)
– Fundort: Tiefseesedimente in Verbindung mit Erdölsickerstellen, Golf von Mexiko(N)
- Stamm B3_Hades(N,B) alias B3 Hades(Y)
- Spezies DG-33 sp001515185(G) [Hadesarchaea archaeon DG-33(N), Hadarchaeota sp. 18(B)]
- Gattung DYFS01(G)
- Spezies DYFS01 sp020725055(G) [Ca. Hadarchaeum sp. isolate BE2011_56_16(N)] (hierher verschoben)
- Spezies DYFS01 sp041490225(G) [Ca. Hadarchaeia archaeon isolate OBJ1_062018_130_12(N)]
- Gattung DYTO01(G)
- Spezies DYTO01 sp020725895(G) [Ca. Hadarchaeum sp. isolate DR5_53_9(N)] (hierher verschoben)
- Stamm DR5_53_9(N,G) alis DR5 53 9(Y)
– Fundort: Grundwasser-Metagenom, Driefontein-Mine im Gebiet vonnCarletonville, Südafrika(N)
- Stamm DR5_53_9(N,G) alis DR5 53 9(Y)
- Spezies DYTO01 sp029259175(G) [Hadesarchaea archaeon isolate S4B4_HD70(N)]
- Stamm S4B4_HD70(N,G)[A. 4]
– Fundort: Guaymas-Becken, Golf von Kalifornien, Mexiko; von Benito Merino, Lipp, Borrel, Boetius & Wegener, geprobt im März 2020 (26. Oktober 2022)(N,B)
- Stamm S4B4_HD70(N,G)[A. 4]
- Spezies DYTO01 sp038823825(G) [Ca. Hadarchaeales archaeon isolate GMQP_201705_bins_5(N)]
- Stamm GMQP_201705_bins_5(N,G)
– Fundort: Pool GMQP (GuMingQuan Pool), Tengchong, Yunnan, China(N) - Stämme JZ-1_201912_bins_37; JZ-1_202101_bins_65; JZ-1_201901_bins_93; JZ-1_202007_bins_14; JZ-2_202101_bins_98; JZ-1_201709_bins_34; JZ-1_201705_bins_92; GMQP_201901_bins_22; GMQP_202101_bins_1; GMQP_201803_bins_20(G)
- Stamm GMQP_201705_bins_5(N,G)
- Spezies DYTO01 sp038872135(G) [Ca. Hadarchaeales archaeon isolate DRTY-6_201808_bins_36(N), Hadarchaeales archaeon isolate DRTY-6_201907_bins_55(N)]
- Spezies DYTO01 sp040755315(G) [Ca. Hadarchaeota archaeon isolate MAG157(N)]
- Stamm MAG157(N,G)
– Fundort: Grundwasser-Metagenom südöstlich des Moschav (Dotfes) Paran im Wadi Araba, Israel(N)
- Stamm MAG157(N,G)
- Spezies DYTO01 sp040757795(G) [Ca. Hadarchaeota archaeon isolate MAG026(N)]
- Stamm MAG026(N,G)
– Fundort: ebenda(N)
- Stamm MAG026(N,G)
- Spezies DYTO01 sp020725895(G) [Ca. Hadarchaeum sp. isolate DR5_53_9(N)] (hierher verschoben)
- Gattung JASEGJ01(G)
- Gattung JASEJC01(G)
- Spezies JASEJC01 sp030016755(G) [Ca. Hodarchaeaceae archaeon isolate Yes71-22(N) (hierher verschoben[A. 22]), Hadesarchaea archaeon isolate Yes46-15(N)]
- Stamm Yes71-22(N,G)
– Fundort: ebenda(N) - Stamm Yes46-15(N,G)
– Fundort: ebenda(N)
- Stamm Yes71-22(N,G)
- Spezies JASEJC01 sp030016755(G) [Ca. Hodarchaeaceae archaeon isolate Yes71-22(N) (hierher verschoben[A. 22]), Hadesarchaea archaeon isolate Yes46-15(N)]
- Gattung JAUWXD01(G)
- Spezies JAUWXD01 sp030616305(G) [Hadesarchaea archaeon isolate CSMAG_2688(N)]
- Stamm CSMAG_2688(N,G)
– Fundort: Metagenom aus einer Kaltquelle (cold seep)(N)
- Stamm CSMAG_2688(N,G)
- Spezies JAUWXD01 sp030616305(G) [Hadesarchaea archaeon isolate CSMAG_2688(N)]
- Gattung JAWCKV01(G)
- Spezies JAWCKV01 sp038851075(G) [Ca. Hadarchaeales archaeon isolate JZ-2_201705_bins_17(N)]
- Spezies JAWCKV01 sp038851565(G) [Ca. Hadarchaeales archaeon isolate JZ-2_201705_bins_153(N)]
- Gattung „Ca. Hadarchaeum“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 20]
- Familie f__JAGGTB01(G)
- Gattung JAGGTB01(G)
- Spezies JAGGTB01 sp021163965(G) [Hadesarchaea archaeon isolate AUK037(N)][A. 24]
- Stamm AUK037(N,G)
– Fundort: Auka-Hydrothermalfeld im Pescadero-Becken, Golf von Kalifornien, Mexiko(N)
- Stamm AUK037(N,G)
- Spezies JAGGTB01 sp021163965(G) [Hadesarchaea archaeon isolate AUK037(N)][A. 24]
- Gattung JAGGTB01(G)
- Familie f__JAWBSP01(G)
- Gattung JAWBSP01(G)
- Spezies JAWBSP01 sp038842485(G) [Ca. Hadarchaeales archaeon isolate JZ-1_201709_bins_109(N)]
- Gattung JAWBSP01(G)
- Familie f__DTKF01(Go)
- Gattung DTKF01(Go)
- Spezies Hadarchaeota sp. 8(B) [DTKF01 sp011367225(Go)]
- Spezies Hadarchaeota sp. 7(B) [DTKF01 sp011370445(Go)}
- Stamm SpSt-85(B,Y)
– Fundort: Great Boiling Spring, Nevada[51]
- Stamm SpSt-85(B,Y)
- Gattung DTKF01(Go)
- Familie DSZJ01(Go)
- Gattung DSZJ01(Go)
- Spezies DSZJ01 sp011361855(Go)
- Stamm SpSt-720, Fundort: Little Hot Creek, Long Valley Caldera[52]
- Spezies DSZJ01 sp011367145(Go)
- Spezies DSZJ01 sp011361855(Go)
- Gattung DSZJ01(Go)
- Ohne Zuweisung zu einer Familie- oder Gattung
- Spezies Ca. Hadarchaeales archaeon isolate 21I_052.bin.44(N)
- Spezies Hadarchaeota sp. 6(B) [„Hadarchaeum HD70-2“(B)[A. 25]]
- Stamm HD70-2(B) (mit Hexadecane70 AT37-06 Mar 2020(B))
- Familie „Ca. Cerberiarchaeaceae“ Benito Merino et al. 2024(Lc,B,Y)
- Nicht näher klassifizierte Vertreter der SAGMEG/Hadesarchaea („SAGMA…“)[57]
- ohne Zuweisung zu einer Ordnung, Familie oder Gattung:
- Spezies Hadarchaeota sp. 9(B) [Hadesarchaea archaeon YNP_N21(N,G,B)]
- Stamm YNP_N21(N,G,B) (GCA_001515215.1) alias YNP N21(Y)
– Fundort: Lower Culex Basin, Yellowstone-Nationalpark, Wyoming, USA(N)
- Stamm YNP_N21(N,G,B) (GCA_001515215.1) alias YNP N21(Y)
- Spezies Hadarchaeota sp. 13(B) [Hadesarchaea archaeon CG08_land_8_20_14_0_20_51_8(N)]
- Stamm CG08_land_8_20_14_0_20_51_8(N,G) alias CG08 land 8 20 14 0 20 51 8(Y) oder CG08_land(B) (GCA_02779005.1/GCA_002779005.1)(B,G)
– Fundort: Crystal Geyser nahe Green River, Utah, USA(N,G)
- Stamm CG08_land_8_20_14_0_20_51_8(N,G) alias CG08 land 8 20 14 0 20 51 8(Y) oder CG08_land(B) (GCA_02779005.1/GCA_002779005.1)(B,G)
- Spezies Hadesarchaea archaeon CR_03(N)
– Fundort: Biosphäre unter dem Meeresboden vor der Küste von Costa Rica(N) - Spezies Hadesarchaea archaeon CR_26(N)
– Fundort: ebenda(N) - Spezies Hadesarchaea archaeon CR_31(N)
– Fundort: ebenda(N) - Hadarchaeota sp. 10(B) [Spezies Hadesarchaea archaeon DG-33-1(N)]
- Stamm DG-33-1(N,G,B,Y) (GCA_001515195.1)
– Fundort: Ästuar des White Oak River, North Carolina(N,G)[17][16]
- Stamm DG-33-1(N,G,B,Y) (GCA_001515195.1)
- Spezies Hadarchaeota sp. 11(B) [Hadesarchaea archaeon isolate DeMMO5_50(N)]
- Stamm DeMMO5_50(N,B) alias DeMMO50 50(Y)
- Spezies Hadarchaeota sp. 12(B) [Hadesarchaea archaeon isolate DeMMO4_9(N)]
- Stamm DeMMO4_9(N,B) alias DeMMO4 9(Y)
- Spezies Hadarchaeota sp. 9(B) [Hadesarchaea archaeon YNP_N21(N,G,B)]
- Ordnung „Ca. Hadarchaeales“ Chuvochina et al. 2023 bzw. 2019(Lc,N,G)[A. 10]
- Klasse „Ca. Persephonarchaeia“ corrig. Mwirichia et al. 2016 bzw. corrig. Adam et al. 2017[60]
[„Ca. Persephonarchaea“ Mwirichia et al. 2016(A,M) bzw. Adam et al. 2017(L*),[42][43]
Persephonearchaea(B),
Mediterranean Seafloor Brine Lake Group 1(A,M), MSBL-1(A,M), MSBL1(N)[61]]
– eine Typusgattung (z. B. Persephonarchaeum) ist noch nicht festgelegt (Stand Juni 2025)[60]- ohne Zuweisung einer Ordnung, Familie oder Gattung
- Spezies Uncultured candidate division MSBL1 archaeon clone Kryos_AWW_A17(N)
- Stamm Kryos_AWW_A17(N)
– Fundort: Halokline des Tiefsee-Solebeckens (deep hypersaline anoxic lake, DHAL) Kryos,[62] östliches Mittelmeer (Libysches Meer), in 3337 m Tiefe.(N)
- Stamm Kryos_AWW_A17(N)
- Spezies Euryarchaeote J3.25-8(N)[63]
- Stamm J3.25-8(N)
– Fundort: anoxisches Hypolimnion des Solar Lake, Sinai in 3,25 m Tiefe(N)[63]
- Stamm J3.25-8(N)
- Spezies Uncultured candidate division MSBL1 archaeon clone DBBA-136(N)
- Stamm DBBA-136(N)
– Fundort: Discovery Solebecken (englisch Discovery Deep, Discovers Brine Pool), Rotes Meer, Saudi-Arabien(N)[64]
- Stamm DBBA-136(N)
- Spezies Candidate division MSBL1 archaeon SCGC-AAA259A05(N,G,A,M,Y)
– Fundort: Discovey Solebecken (englisch Discovery Deep, Discovers Brine Pool), Rotes Meer, Saudi-Arabien(N) - Spezies Candidate division MSBL1 archaeon SCGC-AAA259D14(N,G,A,M,Y)
– Fundort: ebenda(N) - Spezies Candidate division MSBL1 archaeon SCGC-AAA259E19(N,G,A,M)
– Fundort: ebenda(N) - Spezies Candidate division MSBL1 archaeon SCGC-AAA259J03(N,G,A,M)
– Fundort: ebenda(N) - Spezies Candidate division MSBL1 archaeon SCGC-AAA259D18(N,G,M)
– Fundort: ebenda(N) - Spezies Candidate division MSBL1 archaeon SCGC-AAA259B11(N,M)
– Fundorte: ebenda(N,M) - Spezies Candidate division MSBL1 archaeon SCGC-AAA259E17(N,G,M,Y)
– Fundorte: ebenda(N,M) - Spezies Candidate division MSBL1 archaeon SCGC-AAA259E22; SCGC-AAA259I07; SCGC-AAA259I09; SCGC-AAA259I14; SCGC-AAA259M10; SCGC-AAA259O05(N,G,M)
– Fundorte: ebenda(N,M) - Spezies Candidate division MSBL1 archaeon SCGC-AAA261C02, SCGC-AAA261D19; SCGC-AAA261F17; SCGC-AAA261F19; SCGC-AAA261G05; SCGC-AAA261O19; SCGC-AAA833F18; SCGC-AAA833K04(N,M)
– Fundorte: Atlantis II Brine Pool (Atlantis II Deep),[64] Rotes Meer[31](N) - Spezies Candidate division MSBL1 archaeon SCGC-AAA382A03, SCGC-AAA382A13; SCGC-AAA382A20; SCGC-AAA382C18; SCGC-AAA382F02; SCGC-AAA382K21; SCGC-AAA382M17; SCGC-AAA382N08(N,M)
– Fundorte: Nereus Brine Pool (Nereus Deep), Rotes Meer(N,M) - Spezies Candidate division MSBL1 archaeon SCGC-AAA385D11, SCGC-AAA385M02; SCGC-AAA385M11(N,M)
– Fundorte: Erba Brine Pool (Erba Deep), Rotes Meer(N,M)
- Spezies Uncultured candidate division MSBL1 archaeon clone Kryos_AWW_A17(N)
- ohne Zuweisung einer Ordnung, Familie oder Gattung

- Klasse c__B88-G9(G) (G9 = Guay9)[38]
- Ordnung o__B88-G9(G)
- Familie f__B88-G9(G)
- Gattung B88-G9(G)
- Spezies B88-G9 sp003660555(G) [Thermococci archaeon isolate B88_G9(N)] (hierher verschoben)
- Stamm B88_G9(N,G)
– Fundort: Tauchgang 4571 des Tiefsee-U-Boots Alvin: Tiefsee-Hydrothermalschlot-Sedimente, Vent 2, Guaymas-Becken, Golf von Kalifornien, Mexiko(N,G)[38]
- Stamm B88_G9(N,G)
- Spezies B88-G9 sp003660555(G) [Thermococci archaeon isolate B88_G9(N)] (hierher verschoben)
- Gattung B88-G9(G)
- Familie f__B88-G9(G)
- Ordnung o__B88-G9(G)
- (Lc) – List of Prokaryotic names with Standing in Nomenclature (LPSN)
- Phylum „Candidatus Hadarchaeota“ Chuvochina et al. 2019/2023 und Subtaxa[1]
- (Ld) – List of Prokaryotic names with Standing in Nomenclature (LPSN)
- Phylum „Candidatus Hadesarchaeota“ Da Cunha et al. 2017 und Subtaxa[3]
- (L*) – List of Prokaryotic names with Standing in Nomenclature (LPSN)[42]
- Klasse „Candidatus Persephonarchaea“ Adam et al. 2017 (derzeit keine Subtaxa)
- (N) – Taxonomie des National Center for Biotechnology Information (NCBI)[5]
- (G) – Genome Taxonomy Database (GTDB), ohne Autorenschaften[4], (Go) – früherer Eintrag
- (A) – Adam et al. (2017)[2]
- (B) – David Benito Merino et al. (2024)[12]
- (H) – Hua et al. (2019)[13]
- (M) – Mwirichia et al. (2016)[31]
- (Y) – Yu et al. (2024)[11]
Anm.: Der erstgenannte „Stamm“ (bzw. DNA-Sequenz, MAG) ist die Referenz.
Etymologie
Der Name „Hadesarchaea“ wurde zuerst 2016 von Baker et al. vorgeschlagen als eine Anspielung auf den griechischen Gott der Unterwelt Hades,[6][2] für die zuvor provisorisch nach ihrem Fundort „South-African Gold Mine Miscellaneous Euryarchaeal Group“ (SAGMEG) bezeichnete Archaeengruppe.[6][15]
Die vorläufige Bezeichnung der Schwestergruppe der Hadesarchaea, „Mediterranean Seafloor Brine Lake Group 1“ (MSBL1 oder MSBL-1) verweist ebenfalls auf ihren ursprünglichen Fundort. Die von Adam et al. 2017 für diese Gruppe vorgeschlagene Bezeichnung „Persephonarchaea“ verweist auf die griechische Unterweltsgöttin Persephone.[2]
Die Bezeichnung „Stygia“ verweist auf der Unterweltsfluss Styx der griechischen Mythologie, bzw. dessen Flussgöttin (weibliche Form).[2]
Anmerkungen
- ↑ SMC steht für Structural Maintenance of Chromosomes
- ↑ Kite steht für Kleisin Interacting Tandem Elements
- ↑ a b Der Stamm JZ-1 bin_103 gehört laut GTDB zur Spezies „Panguiarchaeum symbiosum“ (Referenzstamm ist jedoch JZ-1.bin_83ᵀ).[45] Mit dem Stamm JZ-1 bin_103 würde ggf. die gesamte Gattung „Ca. Methanourarchaeum“ zur Klasse „Ca. Korarchaeia“ (im Reich Thermoproteati) gehören. Die meisten Autoren bzw. neueren Studien folgen dem nicht (Stand Mitte August 2025). Möglicherweise wurde der Bezeichner doppelt vergeben.
- ↑ a b c d HD70 steht für (anoxic) hexadecane-degrading enrichment at 70 degrees Celsius – (anoxische) Hexadecan-abbauende Anreicherungskultur bei 70 °C
- ↑ Daten zum Vergleich:
- „Ca. Cerberiarchaeum oleivorans“ (Hexadecane70 AT37-06 Mar 2020): Sampling date: Dezember 2016, R/V Atlantis cruises AT37-06, Alvin dive 4869 (27° 0.45′ N 111° 24.54′ W = 27°00'27.0"N 111°24'32.4"W, water depth 2001 m), Metagenom der Anreicherungskultur vom März 2020, Genome size 1.3 Mb, N50: 44 kb, Num. Contigs: 54, GC content: 52 %(B)
- JAPDJF01 sp029259185 S4B3_HD70: Sequenzierung: 2023-03-17, Genome Size: 1.267.874 bp, N50 Contigs: 43.978 bp, Contig Count: 54, GC Percentage: 51.97 %(G), location: 27.0075 N 111.409 W = 27°00'27.0"N 111°24'32.4"W(N)
- ↑ mit den Spezies Hadarchaeota sp. 1 [Ca. Cerberiarchaeum oleivorans], 2 und 3
- ↑ vgl. Methyl-Coenzym-M-Reduktase (Mcr)
- ↑ In der GTDB wird der Stamm AUK037 innerhalb der Ordnung Hadarchaeales verortet.
- ↑ „Ca. Hadarchaeota“ und „Ca. Hadesarchaeota“ gelten in der LPSN nicht als synonym.
- ↑ a b c Gemäß NCBI ist die Autorenschaft Chuvochina et al. 2019 bzw. 2023, d. h. das gültige Jahr ist 2019, und in 2023 ist eine synonyme Beschreibung; in der LPSN ist es umgekehrt.
- ↑ in der LPSN zu „Ca. Hadarchaeota“
- ↑ „Ca. Hadarchaeia“ und „Ca. Hadesarchaea“ gelten in der Taxonomie des NCBI, nicht aber in der LPSN als synonym.
- ↑ „Ca. Hadarchaeales“ und „Ca. Hadesarchaeales“ gelten in der LPSN nicht als synonym.
- ↑ a b „Ca. Cerberiarchaeaceae“ und „Ca. Hadesarchaeaceae“ gelten in der LPSN nicht als synonym.
- ↑ „Ca. Melinoarchaeum“ und „Ca. Hadesarchaeum“ haben den gemeinsamen Stamm JZ-2 bin 199 und werden daher hier als synonym betrachtet; in der LPSN gelten sie jedoch nicht als synonym.
- ↑ Die drei von Benito Merino et al. (2024) in der Hadarchaeota-Spezies 3 zusammengefassten Stämme gehören nach Yu et al. (2024) zur Gattung „Ca. Melinoarchaeum“, was damit auch für diese Spezies gilt.
- ↑ zur Gattung „Ca. Melinoarchaeum“, da die Stämme WYZ-LMO6 und LCB024-034 nach Benito Merino et al. (2024) zu dieser Gattung gehören.
- ↑ zur Familie „Ca. Cerberiarchaeaceae“, gleiche Spezies wie Stamm WYZ-LMO6(B)
- ↑ „Ca. Methanourarchaeum“ gehört nach der LPSN zur Familie „Ca. Hadesarchaeaceae“
- ↑ a b Gemäß NCBI existiert nur die Autorenschaft Chuvochina et al. 2019.
- ↑ In der GTDB ohne Zuordnung, die Stämme gehören jedoch nach Yu et al. (2024) zur selben Gruppe (DG-33) wie die von Hadarchaeota sp. 18, 91, 20(B)
- ↑ a b Wahrscheinlich ein Tipp- oder OCR-Fehler in der NCBI-Taxonomie, es muss wohl entsprechend der GTDB-Klassifizierung korrekt Hadarchaeaceae statt Hodarchaeaceae heißen.
- ↑ Yessentuki mineral water deposit ist eine Quelle (Aquifer) für balneologisch wertvolles Mineralwasser.
- ↑ Bei Benito Merino et al. (2024) wird der Stamm AUK037 zwar innerhalb der Hadarchaeota, aber basal außerhalb der Klassen Hadarchaeia und Persephonearchaea verortet (siehe obige Graphik).[12]
- ↑ die Spezies kann aufgrund der Position im angegebenen phylogenetischen Baum kein Mitglied der Gattung „Ca. Hadarchaeum“ sein
Weiterführende Literatur
- R. John Parkes, Gordon Webster, Barry A. Cragg, Andrew J. Weightman, Carole J. Newberry, Timothy G. Ferdelman, Jens Kallmeyer, Bo B. Jørgensen, Ivano W. Aiello, John C. Fry: Deep sub-seafloor prokaryotes stimulated at interfaces over geological time. In: Nature, Band 436, Nr. 7049, Juli 2007, S. 390–394, ISSN 0028-0836; doi:10.1038/nature03796, PMID 16034418 (englisch).
Einzelnachweise
- ↑ a b c d e LPSN: Phylum "Candidatus Hadarchaeota" Chuvochina et al. 2019.
- ↑ a b c d e f Panagiotis S. Adam, Guillaume Borrel, Céline Brochier-Armanet, Simonetta Gribaldo: The growing tree of Archaea: new perspectives on their diversity, evolution and ecology. In: The ISME journal. Band 11, Nr. 11, November 2017, ISSN 1751-7370, S. 2407–2425, doi:10.1038/ismej.2017.122, PMID 28777382, PMC 5649171 (freier Volltext) – (englisch). Siehe insbes. Fig. 2.
- ↑ a b c d e f g LPSN: Phylum "Candidatus Hadesarchaeota" Da Cunha et al. 2017.
- ↑ a b c d e f GTDB: Hydrothermarchaeota.
- ↑ a b c d e f NCBI Taxonomy Browser: Candidatus Hadarchaeota, Details: "Candidatus Hadarchaeota" Chuvochina et al. 2019. Rank: phylum. Graphisch: Candidatus Hadarchaeota, auf: Lifemap.
- ↑ a b c d e f g h i j k l m n
Brett J. Baker, Jimmy H. Saw, Anders E. Lind, Cassandra Sara Lazar, Kai-Uwe Hinrichs, Andreas P. Teske, Thijs J. G. Ettema: Genomic inference of the metabolism of cosmopolitan subsurface Archaea, Hadesarchaea. In: Nature Microbiology. 1. Jahrgang, Nr. 3, 15. Februar 2016, S. 16002, doi:10.1038/nmicrobiol.2016.2, PMID 27572167 (englisch). Dazu:
- Thijs J. G. Ettema, Brett Baker et al.: Scientists discover new microbes that thrive deep in the earth. Pressemitteilung der Universität Uppsala (UU) vom 15. Februar 2016. Memento im Webarchiv vom 13. August 2020 (englisch).
- Dan Coleman et al.: New microbe found thriving deep in the earth. Pressemitteilung der Universität Uppsala (UU) vom 15. Februar 2016. Memento im Webarchiv vom 3. Juni 2016 (englisch, uu.se).
- Thijs J. G. Ettema: New paper about the Hadesarchaea published! Ettema Lab, 17. Februar 2016, archiviert vom am 4. März 2016 (englisch).
- Hadesarchaea: a New Archaeal Class of Cosmopolitan Deep Microbes. Deep Carbon Observatory, 18. Februar 2016, archiviert vom am 4. März 2016 (englisch, deepcarbon.net).
- Matt Atherton: God of the underworld microbes Hadesarchaea discovered living on toxic gas deep below Yellowstone hot springs. In: IB Times. 15. Februar 2016, abgerufen am 3. August 2025 (englisch, ibtimes.co.uk).
- Underworld microbes shock scientists: Mystery of Hadesarchaea. In: India Today. New Delhi, 17. Februar 2016, archiviert vom am 24. Februar 2016 (englisch, indiatoday.intoday.in).
- ↑ R. John Parkes, Gordon Webster, Barry A. Cragg, Andrew J. Weightman, Carole J. Newberry, Timothy G. Ferdelman, Jens Kallmeyer, Bo B. Jørgensen, Ivano W. Aiello, John C. Fry: Deep sub-seafloor prokaryotes stimulated at interfaces over geological time. In: Nature. 436. Jahrgang, Nr. 7049, Juli 2007, ISSN 0028-0836, S. 390–394, doi:10.1038/nature03796, PMID 16034418 (englisch).
- ↑ a b c Jennifer F. Biddle, Julius S. Lipp, Mark A. Lever, Karen G. Lloyd, Ketil B. Sørensen, Rika Anderson, Helen F. Fredricks, Marcus Elvert, Timothy J. Kelly, Daniel P. Schrag, Mitchell L. Sogin, Jean E. Brenchley, Andreas Teske, Christopher H. House, Kai-Uwe Hinrichs: Heterotrophic Archaea dominate sedimentary subsurface ecosystems off Peru. In: PNAS. 103. Jahrgang, Nr. 10, 27. Februar 2006, ISSN 0027-8424, S. 3846–3851, doi:10.1073/pnas.0600035103, PMID 16505362, PMC 1533785 (freier Volltext) – (englisch).
- ↑ Lotta Purkamo, Malin Bomberg, Riikka Kietäväinen, Heikki Salavirta, Mari Nyyssönen, Maija Nuppunen-Puputti, Lasse Ahonen, Ilmo Kukkonen, Merja Itävaara: Microbial co-occurrence patterns in deep Precambrian bedrock fracture fluids. In: Biogeosciences. 13. Jahrgang, Nr. 10, 30. Mai 2016, ISSN 1726-4189, hdl:10023/10226, S. 3091–3108, doi:10.5194/bg-13-3091-2016 (englisch).
- ↑ Malin Bomberg, Mari Nyyssönen, Petteri Pitkänen, Anne Lehtinen, Merja Itävaara: Active Microbial Communities Inhabit Sulphate-Methane Interphase in Deep Bedrock Fracture Fluids in Olkiluoto, Finland. In: BioMed Research International. 2015. Jahrgang, 3. September 2015, ISSN 2314-6133, S. 979530, doi:10.1155/2015/979530, PMID 26425566, PMC 4573625 (freier Volltext) – (englisch).
- ↑ a b c d e f g h i j Tiantian Yu, Lin Fu, Yinzhao Wang, Yijing Dong, Yifan Chen, Gunter Wegener, Lei Cheng, Fengping Wang: Thermophilic Hadarchaeota grow on long-chain alkanes in syntrophy with methanogens. In: Nature Communications, Band 15, Nr. 1, 2. August 2024, S. 6560; doi:10.1038/s41467-024-50883-z, PMC 11297162 (freier Volltext), PMID 39095478, ResearchGate:382827720 (englisch).
- ↑ a b c d e f
David Benito Merino, Julius S. Lipp, Guillaume Borrel, Antje Boetius, Gunter Wegener: Anaerobic hexadecane degradation by a thermophilic Hadarchaeon from Guaymas Basin. In: The ISME Journal, Band 18, Nr. 1, 10. Januar 2024, S. wrad004; doi:10.1093/ismejo/wrad004, PMC 10811742 (freier Volltext), PMID 38365230, ResearchGate:377312411 (englisch). Dazu:
- Fig. 4,
- Supplement (PDF) – siehe insbes. Fig. S2,
- NCBI Nucleotide: MAG: Hadesarchaea archaeon isolate S4B3_HD70,…. Accession: JAPDJF010000000, lat_lon="27.0075 N 111.409 W", collection_date="2020-03",
- GTDB: GCA_029259185.1: JAPDJF01 sp029259185. NCBI strain identifiers/Isolate S4B3_HD70, Latitude Longitude 27.0075 N 111.409 W,
- NCBI Nucleotide: MAG: Hadesarchaea archaeon isolate S4B4_HD70,…. Accession: JAPDJH010000000, lat_lon="27.0075 N 111.409 W", collection_date="2020-03",
- GTDB: GCA_029259175.1: DYTO01 sp029259175. NCBI strain identifiers/Isolate S4B4_HD70, Latitude Longitude 27.0075 N 111.409 W.
- ↑ a b c d e Zheng-Shuang Hua, Yu-Lin Wang, Paul N. Evans, Yan-Ni Qu, Kian Mau Goh, Yang-Zhi Rao, Yan-Ling Qi, Yu-Xian Li, Min-Jun Huang, Jian-Yu Jiao, Ya-Ting Chen, Yan-Ping Mao, Wen-Sheng Shu, Wael Hozzein, Brian P. Hedlund, Gene W. Tyson, Tong Zhang, Wen-Jun Li: Insights into the ecological roles and evolution of methyl-coenzyme M reductase-containing hot spring Archaea. In: Nature Communications. 10. Jahrgang, Nr. 1, 8. Oktober 2019, ISSN 2041-1723, QUT:PDF, S. 4574, doi:10.1038/s41467-019-12574-y, PMID 31594929, PMC 6783470 (freier Volltext) – (englisch). Siehe insbes. Fig. 1 ③.
- ↑ Brett J. Baker, Luis R. Comolli, Gregory J. Dick, Loren J. Hauser, Doug Hyatt, Brian D. Dill, Miriam L. Land, Nathan C. VerBerkmoes, Robert L. Hettich, and Jillian F. Banfield: Enigmatic, ultrasmall, uncultivated Archaea. In: PNAS, Biological Sciences, Band 107, Nr. 19, 26. April 2010, S. 8806-8811; doi:10.1073/pnas.0914470107 (englisch).
- ↑ a b c d e f Ken Takai, Duane P. Moser, Mary DeFlaun, Tullis C. Onstott, James K. Fredrickson: Archaeal Diversity in Waters from Deep South African Gold Mines. In: Applied and Environmental Microbiology. 67. Jahrgang, Nr. 12, 1. Dezember 2001, ISSN 0099-2240, S. 5750–5760, doi:10.1128/aem.67.21.5750-5760.2001, PMID 11722932, PMC 93369 (freier Volltext) – (englisch).
- ↑ a b c d White Oak River. Mapcarta (deutsch).
- ↑ a b c d The White Oak River. Auf: North Carolina's Southern Outer Banks & Crystal Coast (coastalnc.org).
- ↑ J. Michael Köhler, Franziska Kalensee, Jialan Cao, P. Mike Günther: Hadesarchaea and other extremophile bacteria from ancient mining areas of the East Harz region (Germany) suggest an ecological long-term memory of soil. In: SN Applied Sciences. 1. Jahrgang, Nr. 8, 9. Juli 2019, ISSN 2523-3971, S. 839, doi:10.1007/s42452-019-0874-9 (englisch).
- ↑ Hongpeng Cui, Xin Su, Fang Chen, Melanie Holland, Shengxiong Yang, Jinqiang Liang, Pibo Su, Hailiang Dong, Weiguo Hou: Microbial diversity of two cold seep systems in gas hydrate-bearing sediments in the South China Sea. In: Marine Environmental Research. 144. Jahrgang, Februar 2019, S. 230–239, doi:10.1016/j.marenvres.2019.01.009, PMID 30732863 (englisch).
- ↑ Sushanta Deb, Lipika Das, Subrata K. Das: Composition and functional characterization of the gut microbiome of freshwater pufferfish (Tetraodon cutcutia). In: Archives of Microbiology, Band 202, Nr. 10, Dezember 2020, ISSN 0302-8933, S. 2761–2770; doi:10.1007/s00203-020-01997-7, PMID 32737543 (englisch).
- ↑ Adrien Vigneron, Perrine Cruaud, Patricia Pignet, Jean-Claude Caprais, Marie-Anne Cambon-Bonavita, Anne Godfroy, Laurent Toffin: Archaeal and anaerobic methane oxidizer communities in the Sonora Margin cold seeps, Guaymas Basin (Gulf of California), Microbial Ecology and Functional Diversity of Natural Habitats. In: Nature: The ISME Journal, Band 7, S. 1595–1608, 28. Februar 2013; doi:10.1038/ismej.2013.18 (englisch).
- ↑ Adrien Vigneron, Perrine Cruaud, Erwan G. Roussel, Patricia Pignet, Jean-Claude Caprais, Nolwenn Callac, Maria-Cristina Ciobanu, Anne Godfroy, Barry A. Cragg, John R. Parkes, Joy D. Van Nostrand, Zhili He, Jizhong Zhou, Laurent Toffin: Phylogenetic and Functional Diversity of Microbial Communities Associated with Subsurface Sediments of the Sonora Margin, Guaymas Basin. In: PLOS ONE, 6. August 2014; doi:10.1371/journal.pone.0104427 (englisch).
- ↑ Gustavo A. Ramírez, Luke J. McKay, Matthew W. Fields, Andrew Buckley, Carlos Mortera, Christian Hensen, Ana Christina Ravelo, Andreas P. Teske: The Guaymas Basin Subseafloor Sedimentary Archaeome Reflects Complex Environmental Histories. In: iScience. 23. Jahrgang, Nr. 9, September 2020, S. 101459, doi:10.1016/j.isci.2020.101459, PMID 32861995, PMC 7476861 (freier Volltext) – (englisch).
- ↑ NCBI Nucleotide: MAG: Hadesarchaea archaeon DG-33
- ↑ NCBI Taxonomy Browser: Candidatus Hadarchaeum yellowstonense Chuvochina et al. 2019, includes: Hadesarchaea archaeon YNP_45; und Nucleotide: MAG: Candidatus Hadarchaeum yellowstonense isolate YNP_45
- ↑ NCBI Assembly: ASM1133505v1 (März 2020) und BioSample: SAMN09639887 (Zhichao Zhou, Universität Hongkong, Juli 2018). Anm.: Die angegebenen Koordinaten von der Entnahmestelle der Probe vom Oktober 2012 zeigen auf den Obsidian Pool.
- ↑ Yinzhao Wang, Gunter Wegener, Jialin Hou, Fengping Wang, Xiang Xiao: Expanding anaerobic alkane metabolism in the domain of Archaea. In: Nature Microbiology. 4. Jahrgang, Nr. 4, 4. März 2019, ISSN 2058-5276, S. 595–602, doi:10.1038/s41564-019-0364-2, PMID 30833728 (englisch).
- ↑ Jolien J. E. van Hooff, Maximilian W. D. Raas, Eelco C. Tromer, Laura Eme: Repeated duplications and losses shaped SMC complex evolution from archaeal ancestors to modern eukaryotes. In: Cell Reports, Band 44, Nr. 7, 22. Juli 2025, S. 115855; doi:10.1016/j.celrep.2025.115855 (englisch).
- ↑ a b c d Václav Brázda, Yu Luo, Martin Bartas, Patrik Kaura, Otilia Porubiaková, Jiří Šťastný, Petr Pečinka, Daniela Verga, Violetta Da Cunha, Tomio S. Takahashi, Patrick Forterre, Hannu Myllykallio, Miroslav Fojta. Jean-Louis Mergna: G-Quadruplexes in the Archaea Domain. In: MDPI: Biomolecules, Band 10, Nr. 9, Collection Archaea: Diversity, Metabolism and Molecular Biology, 21. September 2020, S. 1349; doi:10.3390/biom10091349 (englisch).
- ↑ a b Timothy M. Ghaly: On the taxonomy and functions of integrons. Doktorarbeit an der Macquarie University, Sydney, New South Wales, Australien; 20. Juni 2022; PDF (englisch).
- ↑ a b c d Romano Mwirichia, Intikhab Alam, Mamoon Rashid, Manikandan Vinu, Wail Ba-Alawi, Allan Anthony Kamau, David Kamanda Ngugi, Markus Göker, Hans-Peter Klenk, Vladimir Bajic, Ulrich Stingl: Metabolic traits of an uncultured archaeal lineage--MSBL1--from brine pools of the Red Sea. In: Scientific Reports, Band 6, Nr. 19181, 13. Januar 2016; doi:10.1038/srep19181, PMC 4725937 (freier Volltext), PMID 26758088 (englisch). Siehe insbes. Fig. 1.
- ↑ Xingqi Liu, Hailiang Dong, Jason Rech, Ryo Matsumoto, Yang Bo, Yongbo Wang: Evolution of Chaka Salt Lake in NW China in response to climatic change during the Latest Pleistocene–Holocene. In: Quaternary Science Reviews. 27. Jahrgang, Nr. 7–8, 1. April 2008, ResearchGate:223837328, S. 867–879, doi:10.1016/j.quascirev.2007.12.006 (englisch).
- ↑ Salt Lake: Mirror of the sky in China. Government of China (english.www.gov.cn). Memento im Webarchiv vom 19. Februar 2023.
- ↑ Hongchen Jiang, Hailiang Dong, Gengxin Zhang, Bingsong Yu, Leah R. Chapman, Matthew W. Fields: Microbial Diversity in Water and Sediment of Lake Chaka, an Athalassohaline Lake in Northwestern China. In: Applied and Environmental Microbiology, Band 72, Nr. 6, Juni 2006, S. 3832–3845; doi:10.1128/AEM.02869-05, PMC 1489620 (freier Volltext), PMID 16751487 (englisch).
- ↑ Anne Kelly Kambura, Romano Kachiuru Mwirichia, Remmy Wekesa Kasili, Edward Nderitu Karanja, Huxley Mae Makonde & Hamadi Iddi Boga: Bacteria and Archaea diversity within the hot springs of Lake Magadi and Little Magadi in Kenya. In: BMC Microbiology, Band 16, Nr. 136, 7. Juli 2016; doi:10.1186/s12866-016-0748-x (englisch). Siehe insbes. Supplement #6.
- ↑ Federica De Lise, Andrea Strazzulli, Roberta Iacono, Nicola Curci, Mauro Di Fenza, Luisa Maurelli, Marco Moracci, Beatrice Cobucci-Ponzano: Programmed Deviations of Ribosomes From Standard Decoding in Archaea. In: Frontiers in Microbiology, Band 12, Sec. Biology of Archaea, 4. Juni 2021, ISSN 1664-302X, S. 688061; doi:10.3389/fmicb.2021.688061 (englisch).
- ↑ Yue Guan, Mohamed F. Haroon, Intikhab Alam, James G. Ferry, Ulrich Stingl: Single-cell genomics reveals pyrrolysine-encoding potential in members of uncultivated archaeal candidate division MSBL1. In: Environmental Microbiology Reports, Band 9, Nr. 4, August 2017, S. 404-410: doi:10.1111/1758-2229.12545, Epub 10. Mai 2017 (englisch).
- ↑ a b c Nina Dombrowski, Andreas P. Teske, Brett J. Baker: Expansive microbial metabolic versatility and biodiversity in dynamic Guaymas Basin hydrothermal sediments. In: Nature Communications, Band 9, Nr. 4999, 27. November 2018; doi:10.1038/s41467-018-07418-0 (englisch).
- ↑ NCBI Nucleotide: Search: B88-G9. Dazu:
- ↑
GTDB: NCBI Strain Identifiers CONTAINS B88_G9. Dazu:
- GCA_003660555.1: B88-G9 sp003660555. NCBI strain identifiers: B88_G9.
- B88-G9 sp003660555 (Tree View).
- ↑ Paul N. Evans, Joel A. Boyd, Andy O. Leu, Ben J. Woodcroft, Donovan H. Parks, Philip Hugenholtz, Gene W. Tyson: An evolving view of methane metabolism in the Archaea. In: Nature Reviews Microbiology. 17. Jahrgang, Nr. 4, April 2019, ISSN 1740-1534, S. 219–232, doi:10.1038/s41579-018-0136-7, PMID 30664670 (englisch).
- ↑ a b c LPSN: Class "Candidatus Persephonarchaea" Adam et al. 2017.
- ↑ a b Paul W. J. J. van der Wielen, Henk Bolhuis, Sara Borin, Daniele Daffonchio, Cesare Corselli, Laura Giuliano, Giuseppe D'Auria, Gert J. de Lange, Andreas Huebner, Sotirios P. Varnavas, John Thomson, Christian Tamburini, Danielle Marty, Terry J. McGenity, Kenneth N. Timmis, et al.: The enigma of prokaryotic life in deep hypersaline anoxic basins. In: Science, Band 307, Nr. 5706, 7. Januar 2005, S. 121-123.; doi:10.1126/science.1103569, PMID 15637281 (englisch).
- ↑ LPSN: Superclass "Stygia" Adam et al. 2017.
- ↑ GTDB: Panguiarchaeum symbiosum.
- ↑ GTDB: GCA_011335055.1: Hadarchaeum yellowstonense SpSt-756.
- ↑ NCBI Assembly: ASM1133505v1 (März 2020) und BioSample: SAMN09639887 (Zhichao Zhou, Universität Hongkong, Juli 2018). Anm.: Die angegebenen Koordinaten von der Entnahmestelle der Probe vom Oktober 2012 zeigen auf den Obsidian Pool.
- ↑ NCBI Nucleotide: MAG: Hadesarchaea archaeon isolate MAG-18,….
- ↑ Olga A. Podosokorskaya, Alexander G. Elcheninov, Sergey N. Gavrilov, Nika F. Petrova, Alexandra A. Klyukina, Daria G. Zavarzina, Alexander Y. Merkel: New Representatives of the Class Ignavibacteria Inhabiting Subsurface Aquifers of Yessentuki Mineral Water Deposit. In: MDPI: Water, Section Biodiversity and Functionality of Aquatic Ecosystems, Band 15, Nr. 19, 30. September 2023, S. 3451; doi:10.3390/w15193451 (englisch).
- ↑ Vinsady. Geonames.
- ↑ Great Boiling Spring. Auf: blackrockdesert.org/
- ↑ NCBI Assembly: ASM1136185v1 (März 2020) und BioSample: SAMN09639848 (Zhichao Zhou, Universität Hongkong, Juli 2018).
- ↑ NCBI Assembly: ASM1136714v1 (März 2020) und BioSample: SAMN09639709 (Zhichao Zhou, Universität Hongkong, Juli 2018).
- ↑ "28.25 N 91.81 E" (mappingsupport.com).
- ↑ Nara Yumco. GeoNames
- ↑ Quzhuomucun. GeoNames.
- ↑ NCBI Taxonomy Browser: Search: Uncultured archaeon SAGMA*.
- ↑ NCBI Taxonomy Browser: uncultured archaeon SAGMA-J (species).
- ↑ NCBI Taxonomy Browser: uncultured archaeon SAGMA-J (species).
- ↑ a b Aharon Oren, Marko Kostovski, Markus Göker: Candidatus List No. 6. In: International Journal of Systematic and Evolutionary Microbiology, Band 75, Nr. 6, 30. Juni 2025, S. 006772; doi:10.1099/ijsem.0.006772, PMC 12281948 (freier Volltext), PMID 40590423 (englisch).
- ↑ NCBI Taxonomy Browser: Candidate division MSBL1, Details: Candidate division MSBL1. Graphisch: Candidate division MSBL1 Hydrothermarchaeota, auf: Lifemap.
- ↑ Michail M. Yakimov, Violetta La Cono, Gina L. Spada, Giovanni Bortoluzzi, Enzo Messina, Francesco Smedile, Erika Arcadi, Mireno Borghini, Manuel Ferrer, Phillippe Schmitt-Kopplin, Norbert Hertkorn, Jonathan A. Cray, John E. Hallsworth, Peter N. Golyshin, Laura Giuliano: Microbial community of the deep-sea brine Lake Kryos seawater-brine interface is active below the chaotropicity limit of life as revealed by recovery of mRNA. In: Environmental Microbiology, Band 17, Nr. 2, Februar 2015, S. 364-382; doi:10.1111/1462-2920.12587, Epub 26. Januar 2015 (englisch).
- ↑ a b Eddie Cytryn, Dror Minz, Ronald S. Oremland, Yehuda Cohen: Distribution and Diversity of Archaea Corresponding to the Limnological Cycle of a Hypersaline Stratified Lake (Solar Lake, Sinai, Egypt). In: ASM Journals: Applied and Environmental Microbiology, Band 66, Nr. 8, S. 3269-3276, 1. August 2000; doi:10.1128/AEM.66.8.3269-3276.2000, PMC 92144 (freier Volltext), PMID 10919780 (englisch).
- ↑ a b Carlos M. Duarte, Anders Røstad, Grégoire Michoud, Alan Barozzi et al.: Discovery of Afifi, the shallowest and southernmost brine pool reported in the Red Sea. In: Springer Nature: Scientific Reports, Band 10, Nr. 1, Januar 2020; doi:10.1038/s41598-020-57416-w, ResearchGate:338749632. Projekt: Geological evolution of the Red Sea and Gulf of Aqaba. Siehe insbes. Fig. 1.