Cyanamide
| Cyanamide |
|---|
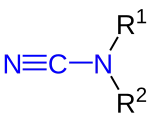
|
| R1 und R2 sind organische Reste (Alkyl, Aryl o. ä.) oder Wasserstoffatome. |
Cyanamide sind eine Stoffgruppe der Chemie, deren Vertreter sich von Cyanamid ableiten und eine an ein Stickstoffatom gebundene Cyanogruppe aufweisen. Salzartige Cyanamide können durch Alkylierung in organische Cyanamide umgewandelt werden. Diese können außerdem beispielsweise aus Aminen, Cyanaten oder Harnstoffen hergestellt werden. Cyanamide lassen sich unter anderem in Harnstoffe, Amidine und Guanidine umwandeln und vielfältig in Cycloadditionen einsetzen.
Geschichte
Cyanamide wurden erstmals in den 1850er-Jahren beschrieben.[1]
Herstellung
Aus Cyanamid-Salzen
Eine einfache und wichtige Methode zur Herstellung von organischen Cyanamiden ist die Alkylierung eines Cyanamidsalzes wie Calciumcyanamid mit einem Alkylbromid. Mit dieser Methode können jedoch nur disubstituierte Cyanamide mit zwei identischen Substituenten erhalten werden.[1]
Aus Aminen
Amine können durch Reaktion mit elektrophilen Cyano-Verbindungen in Cyanamide umgewandelt werden.[2] Zu diesen Reagenzien gehören beispielsweise Halogencyane wie Chlorcyan oder Bromcyan hergestellt werden. Dabei können primäre, sekundäre und tertiäre Amine verwendet werden. Im Fall der Reaktion von tertiären Aminen mit Bromcyan entsteht zunächst eine quartäre Stickstoffspezies, dann unter Eliminierung eines Alkylbromids ein zweifach substituiertes Cyanamid.[1] Verbreitet ist insbesondere die Verwendung von Bromcyan, das allerdings sehr giftig ist. Alternativen sind zum Beispiel Cyanobenzimidazol und 1-Cyanoimidazol. Durch Reaktion von Trimethylsilylcyanid mit Natriumhypochlorit kann in situ Chlorcyan hergestellt werden, mit dem sekundäre Amine analog in Cyanamide umgewandelt werden können.[2]
Eine hochselektive Reaktion ausgehend von sekundären Aminen nutzt Trichloracetonitril und Natrium-tert-amylat. Verschiedene Methoden funktionieren unter Katalyse mit Kupfer. Dazu gehört die Reaktion mit Kupfer(I)-cyanid als Quelle von Cyanogruppen, Natriumsulfat, TMEDA sowie einer katalytischen Menge Kupfer(II)-bromid. Eine andere Methode ist die Reaktion mit Azobis(isobutyronitril) als Quelle von Cyanogruppen, Kaliumcarbonat und Kupfer(I)-iodid als Katalysator.[2] Chloramine können mit Cyanidsalzen wie Kaliumcyanid zu Cyanamiden umgesetzt werden.[1]
Aus Amidoximen, Harnstoffen und Thioharnstoffen
Harnstoffe und Amidoxime können durch Dehydratisierung in Cyanamide überführt werden, erstere zum Beispiel mit Triphenylphosphindibromid oder Dichlorcarben, letztere zum Beispiel mit Phosphorylchlorid. Analog können Thioharnstoffe durch Abspaltung von Schwefelwasserstoff, beispielsweise mit Carboddiimiden, in Cyanamide überführt werden.[1]
Cyanamide mit nur einem organischen Rest können ausgehend von Nitrilen hergestellt werden, indem diese zunächst in ein Amidoxim umgewandelt werden. Das Edukt wird dazu mit Hydroxylamin in Ethanol behandelt. Das Amidoxim wird im zweiten Schritt mit Tosylchlorid sowie einer Base (Pyridin oder Diisopropylethylamin) in Dichlormethan zum Cyanamid umgesetzt.[2]
Aus anderen Edukten
Die Reaktion eines sekundären oder tertiärem Amins mit einem aromatischen Cyanat ergibt ein disubstituiertes Cyanamid, ebenso wie die Reaktion eines sekundären Cyanamids mit einem Thiocyanat in Gegenwart von Cadmiumoxid. Carbylaminchloride können durch Reaktion mit Ammoniak zu Cyanamiden umgesetzt werden.[1] Eine andere Synthesemöglichkeit ist die Reaktion von Isonitrilen mit Trimethylsilylazid unter Palladiumkatalyse.[3]
Eigenschaften und Reaktionen
Cyanamide sind tautomer zu Carbodiimiden.[3] Ihre Aminogruppe verhält sich meist ähnlich einer Aminogruppe in einem Amin, ist durch Konjugation aber deutlich weniger basisch und nucleophil.[1] Bei Reaktion mit Säuren erfolgt die Protonierung am Stickstoff der Cyanogruppe.[1][3] Die Hydrolyse disubstituierter Cyanamide mit verdünnter Säure führt zu einem Harnstoff. Mit konzentrierter Säure entsteht unter Decarboxylierung ein sekundäres Amin. Analog zur Hydratisierung ist die Addition von Schwefelwasserstoff zu einem Thioharnstoff oder von Selenwasserstoff zu einem Selenoharnstoff möglich. Mit Alkoholen beziehungsweise Alkoholaten reagieren sie zu Imidoestern.[3] Amine sind zu wenig nucleophil um direkt, also ohne Katalyse, an Cyanamide zu addieren, Metallamide (zum Beispiel in situ hergestellt aus einem sekundären Amin und tert-Butyllithium) sind jedoch geeignet und Hydroxylamin reagiert direkt.[1] Die Addition von solchen Stickstoffnucleophilen ergibt Guanidine.[3] Die Addition von Grignard-Verbindungen an Cyanamide (sowohl einfach als auch zweifach substituierte) führt zu Amidinen.[1]
Einfach substituierte Cyanamide können vergleichsweise leicht unter Bildung eines Salzes deprotoniert werden oder weiter alkyliert werden. Sie können außerdem mit Carbonsäurechloriden acyliert werden, mit Natriumnitrit nitrosiert und mit tert-Butylhypochlorit chloriert. Zweifach substituierte Cyanamide werden an der Cyanogruppe alkyliert, wodurch ein instabiles Nitriliumsalz erhalten wird. Die Reaktion disubstituierter Cyanamide mit Salpetersäure ermöglicht die Nitrierung, die dann unter Absptaltung von Nitrylisocyanat zu einem sekundären Amin führt.[1]
Cyanamide eignen sich als Reagenzien zur Herstellung von Heterocyclen über Cycloadditionen,[2] unter anderem als Dienophil in Diels-Alder-Reaktionen[1] sowie in [3+2]-Cycloadditionen, zum Beispiel mit Natriumazid und in [2+2]-Cycloadditionen, zum Beispiel mit Woollins’ Reagenz.[3] Mit Alkinen können aminosubstituierte Oxazole hergestellt werden. Mit N-Boc-hydroxylamin werden 1,2,4-Oxadiazole erhalten.[2] Einfach substituierte Cyanamide trimerisieren leicht unter Bildung eines Sechsrings.[1]
Das Cyanamid tert-Butyl-N-chlorcyanamid ist ein Reagenz, das unter anderem Aldoxime zu N-Hydroxyimidoylchloriden chlorieren oder Thiole zu Disulfiden oxidieren kann.[3]
Komplexe
Cyanamide bilden Komplexe mit Metallen, beispielsweise sind Komplexe von Diethylcyanamid mit Eisen, Osmium und Ruthenium bekannt. Weitere Komplexe sind unter anderem mit Quecksilber, Nickel und Zinn bekannt.[2]
Einzelnachweise
- ↑ a b c d e f g h i j k l m D. D. Nekrasov: Synthesis and chemical transformations of mono- and disubstituted cyanamides. In: Russian Journal of Organic Chemistry. Band 40, Nr. 10, Oktober 2004, S. 1387–1402, doi:10.1007/s11178-005-0030-4.
- ↑ a b c d e f g M. Prabhath, Luke Williams, Shreesha Bhat, Pallavi Sharma: Recent Advances in Cyanamide Chemistry: Synthesis and Applications. In: Molecules. Band 22, Nr. 4, 12. April 2017, S. 615, doi:10.3390/molecules22040615, PMID 28417938, PMC 6154562 (freier Volltext).
- ↑ a b c d e f g Marie-Hélène Larraufie, Giovanni Maestri, Max Malacria, Cyril Ollivier, Louis Fensterbank, Emmanuel Lacôte: The Cyanamide Moiety, Synthesis and Reactivity. In: Synthesis. Band 44, Nr. 09, Mai 2012, S. 1279–1292, doi:10.1055/s-0031-1289749.