Amidoxime
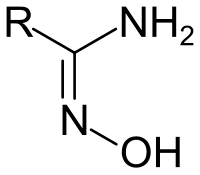
Amidoxime sind eine Stoffgruppe der organischen Chemie. Sie zeichnen sich dadurch aus, dass am selben Kohlenstoffatom sowohl eine Oximgruppe als auch eine Aminogruppe vorhanden ist. Demnach handelt es sich formal um N-Hydroxyderivate von Amidinen oder um Oxime von Carbonsäureamiden.
Geschichte
Die erste Synthese eines Amidoxims, Formamidoxim, wurde 1873 beschrieben. Die Struktur von Amidoximen wurde jedoch erst 1884 zum ersten Mal beschrieben.[1]
Herstellung
Die meisten Herstellungsmethoden für Amidoxime basieren auf der Reaktion von Hydroxylamin mit einer anderen Verbindung. Geeignete Reaktionspartner sind beispielsweise Nitrile, Thionamide, Amidine (als Hydrochloride) und Imidate. Daneben sind aber auch noch einige andere Verfahren möglich, wie die Reaktion von Ammoniak mit einem N-Hydroxyimidat oder einem Hydroxyimidoylchlorid oder die Reaktion von Schwefelwasserstoff mit einer Nitrosolsäure. Die Addition von Hydroxylamin an Nitrile ist die gängigste unter diesen Methoden.[1]
Reaktionen
Amidoxime wie Methylamidoxim, Benzamidoxim, Pyridin-2-amidoxim oder Pyridin-4-amidoxim reagieren mit Oxidationsmitteln wie Kaliumhexacyanidoferrat(III) unter Freisetzung von Stickstoffmonoxid. Dabei werden sie beispielsweise zu Carbonsäureamiden oder Nitrilen umgesetzt sowie teilweise dimerisiert. Die konkreten Produkte hängen dabei vom Oxidationsmittel ab. Blei(IV)-acetat und Silbercarbonat führen bevorzugt zu Nitrilen, während andere Oxidationsmittel wie Wasserstoffperoxid, tert-Butylhydroperoxid und meta-Chlorperbenzoesäure zu Carbonsäureamiden führen.[1] Die Reaktion von Amidoximen mit Acylierungsmitteln ergibt 1,2,4-Oxadiazole. Geeignete Reagenzien sind Carbonsäurechloride, Carbonsäureanhydride und Aktivester, beispielsweise Enolester, sowie Ester der Dichloressigsäure und Trichloressigsäure.[2] Die Tiemann-Umlagerung ist eine Namensreaktion, bei der ein Amidoxim mit Benzolsulfonylchlorid umgesetzt wird, wobei es sich zu einem Harnstoff umlagert.[3]
Verwendung
Das Fungizid Cyflufenamid wird der Wirkstoffgruppe der Amidoxime zugeordnet.[4] Es enthält eine Amidoximfunktion, die jedoch in Form eines Oximethers vorliegt.
Einzelnachweise
- ↑ a b c Tanya Sahyoun, Axelle Arrault, Raphaël Schneider: Amidoximes and Oximes: Synthesis, Structure, and Their Key Role as NO Donors. In: Molecules. Band 24, Nr. 13, 5. Juli 2019, S. 2470, doi:10.3390/molecules24132470, PMID 31284390, PMC 6651102 (freier Volltext).
- ↑ John A. Durden, D. L. Heywood: Reaction of "activated" esters with amidoximes. Convenient synthesis of 1,2,4-oxadiazoles. In: The Journal of Organic Chemistry. Band 36, Nr. 9, Mai 1971, S. 1306–1307, doi:10.1021/jo00808a034.
- ↑ Jie Jack Li: Name Reactions: A Collection of Detailed Reaction Mechanisms. Springer Science & Business Media, 2013, ISBN 978-3-662-05336-2, S. 408 (google.de [abgerufen am 16. Mai 2025]).
- ↑ Fungizide. In: Pflanzenkrankheiten und Pflanzenschutz. Springer Berlin Heidelberg, Berlin, Heidelberg 2009, ISBN 978-3-540-49067-8, S. 497, doi:10.1007/978-3-540-49068-5_22.