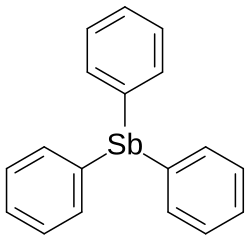
Triphenylstiban
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Triphenylstiban | |||||||||||||||
| Andere Namen |
Triphenylstibin | |||||||||||||||
| Summenformel | C18H15Sb | |||||||||||||||
| Kurzbeschreibung |
beiger Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 353,1 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt |
52–54 °C[1] | |||||||||||||||
| Siedepunkt |
377 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Triphenylstiban (auch Triphenylantimon) ist eine organische Verbindung, in der drei Phenylgruppen an ein Antimonatom gebunden sind. Es gehört einer Reihe von Verbindungen an, in der drei Phenylgruppen an ein Element der fünften Hauptgruppe gebunden sind. Die anderen Vertreter sind das Triphenylamin, Triphenylphosphan, Triphenylarsan sowie das Triphenylbismutan.

Herstellung
Triphenylstiban kann ausgehend von Anilin hergestellt werden, indem dieses in Gegenwart von Salzsäure und Antimon(III)-chlorid mit Natriumnitrit diazotiert und anschließend mit Zink umgesetzt wird.[3] Andere Methoden sind die Reaktion unter Erhitzen von Antimon-Pulver mit Phenyllithium in Xylol; mit Lithiumtetraphenylaluminat[S 1] und Iodbenzol bei 110 °C oder mit Tetraphenylzinn bei 400 °C. Eine weitere Alternative ist die Reaktion von Lithiumantimonid mit Brombenzol.[4]
Reaktionen
Die Oxidation, zum Beispiel mit Wasserstoffperoxid, ergibt Triphenylstibanoxid.[S 2][5] Triphenylstiban eignet sich als Katalysator für Biginelli-Reaktionen.[6] Durch Reaktion von Triphenylstiban mit elementarem Natrium und Tributylzinnchlorid wird Tributyl(diphenylantimonyl)zinn[S 3] erhalten, dieses kann in einer palladiumkatalysierten Kreuzkupplung mit einem Aryliodid oder Triflat umgesetzt werden, um eine andere, dritte Arylgruppe an das Antimon zu binden. Möglich ist beispielsweise die Reaktion mit 1-Napththyltriflat[S 4] und entweder Tetrakis(triphenylphosphin)palladium(0) oder Bis(triphenylphosphin)palladium(II)-chlorid als Katalysator.[7]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Triphenylantimony(III) bei Sigma-Aldrich, abgerufen am 30. Januar 2025 (PDF).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag antimony compounds, with the exception of the tetroxide (Sb2O4), pentoxide (Sb2O5), trisulphide (Sb2S3), pentasulphide (Sb2S5) and those specified elsewhere in this Annex in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Juni 2025. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ A. N. Nesmeyanov, N. K. Gipp, L. G. Makarova, K. K. Mozgova: Use of the salt (C6I5N2Cl)2•SbCl3 in the double-diazonium-salt method. In: Bulletin of the Academy of Sciences of the USSR Division of Chemical Science. Band 2, Nr. 2, 1954, S. 271–274, doi:10.1007/BF01170998.
- ↑ Michael Dub: Antimony. In: Compounds of Arsenic, Antimony, and Bismuth. Springer Berlin Heidelberg, Berlin, Heidelberg 1968, ISBN 978-3-662-01613-8, S. 653, doi:10.1007/978-3-662-01611-4_2.
- ↑ John S. Wenger, Monica Weng, Graham N. George, Timothy C. Johnstone: Isolation, bonding and reactivity of a monomeric stibine oxide. In: Nature Chemistry. Band 15, Nr. 5, Mai 2023, S. 633–640, doi:10.1038/s41557-023-01160-x, PMID 36959510, PMC 10159848 (freier Volltext).
- ↑ Anamika Khaskel, Santosh Kumari Bajiya, Suman Lata, Rakesh Kumar Sharma, Shatabdi Basu: SbPh 3 : An Efficient Catalyst for Dihydropyrimidinone and Dihydropyrimidin-5-carboxamide Synthesis Using the Biginelli Reaction. In: Organic Preparations and Procedures International. Band 55, Nr. 6, 2. November 2023, S. 525–537, doi:10.1080/00304948.2023.2190711.
- ↑ Mariana Bonaterra, Sandra E. Martín, Roberto A. Rossi: One-Pot Palladium-Catalyzed Cross-Coupling Reaction of Aryl Iodides with Stannylarsanes and Stannylstibanes. In: Organic Letters. Band 5, Nr. 15, 1. Juli 2003, S. 2731–2734, doi:10.1021/ol0349357.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Lithiumtetraphenylaluminat: CAS-Nr.: 62126-57-2, PubChem: 21930649, Wikidata: Q131936713.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Triphenylstibanoxid: CAS-Nr.: 4756-75-6, PubChem: 78497, Wikidata: Q83070147.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Tributyl(diphenylantimonyl)zinn: CAS-Nr.: 101319-95-3, PubChem: 85524803, Wikidata: Q131936791.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1-Napththyltriflat: CAS-Nr.: 99747-74-7, EG-Nr.: 623-315-0, ECHA-InfoCard: 100.152.005, PubChem: 378884, ChemSpider: 335716, Wikidata: Q83128535.

