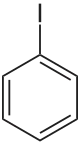
Iodbenzol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Iodbenzol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H5I | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 204,01 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,823 g·cm−3 (25 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Iodbenzol (C6H5I) ist eine chemische Verbindung, hier insbesondere ein aromatischer Halogenkohlenwasserstoff. Das Molekül ist wie Benzol aufgebaut, eines der sechs Wasserstoff-Atome des Benzols ist durch ein Iod-Atom ersetzt.
Darstellung
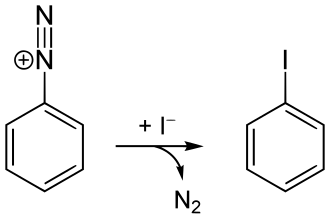
Eine Darstellung durch Halogenierung wie bei Chlor- und Brombenzol ist schwer möglich. Eine Iodierung von Benzol gelingt in Gegenwart von Salpetersäure.[1] Die Synthese kann auch im Zuge einer Sandmeyer-Reaktion mit einer Diazotierung von Anilin und anschließender Zugabe einer Iodid-Lösung (z. B. von Natriumiodid) unter Abspaltung von Stickstoff erfolgen[1][2]:
Eigenschaften
Iodbenzol ist eine farblose, brennbare Flüssigkeit, die sich infolge einer Iodbildung bei der Lagerung in Gegenwart von Luft gelblich gefärbt haben kann.[1][2][4] Die Verbindung ist weitgehend unpolar, daher in Wasser unlöslich, in Alkoholen, Benzol und Ethern löslich. Sie ist bei Raumtemperatur stabil, kann sich bei starken Erhitzen auf Temperaturen über 200 °C explosionsartig zersetzen. Mit starken Oxidationsmitteln wird Iodoxybenzol gebildet, welches sich ebenfalls bei erhöhter Temperatur explosionsartig zersetzen kann.[5]
Verwendung
Iodbenzol kann als Immersionsflüssigkeit zur Bestimmung der Brechzahl von Mineralien verwendet werden. In der organischen Synthesechemie dient es als Reagenz zur Herstellung von Biarylen mittels Ullmann-Synthese, zur Kupplung sekundärer Amine, von Acrylverbindungen und Allylalkoholen, zur Herstellung von Cinnamylphosphonaten und zur durch Palladium katalysierten Arylierung von 4H-1,3-Dioxinen. Es können durch Oxidation organische Iod(III)-Verbindungen, wie Iodosylbenzol erhalten werden.[1]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Iodbenzen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. April 2025.
- ↑ a b c d e P.A.L. Lyday; T. Kaiho: Iodine and Iodine Compounds, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2015; doi:10.1002/14356007.a14_381.pub2.
- ↑ a b c d e f Datenblatt Iodobenzene bei Sigma-Aldrich, abgerufen am 19. August 2017 (PDF).
- ↑ a b Eintrag zu Iodobenzene bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Iodbenzol, CD-ROM Ausgabe 12/2024, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4 .
