Spermidin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
butane-1%252C4-diamine_200_2.svg.png)
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Spermidin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C7H19N3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, klare Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 145,25 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,93 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Spermidin, auch Monoaminopropylputrescin genannt, ist ein biogenes Polyamin. In Säugetierzellen und Bakterien[2] entsteht es aus Putrescin durch Übertragung einer Aminopropylgruppe von decarboxyliertem S-Adenosylmethionin, katalysiert durch Spermidin-Synthase. Durch Übertragung einer weiteren Aminopropylgruppe mit Hilfe von Spermin-Synthase entsteht daraus Spermin.[3] Die Polyamine sind unverzichtbare und allgemein verfügbare Bestandteile von eukaryonten Zellen, zuständig für deren normales Wachstum und Entwicklung.
Die Namen Spermidin und auch Spermin sind von der männlichen Samenflüssigkeit abgeleitet. Sie wurden von Philipp Schreiner 1870 erstmals aus Sperma isoliert und 1878 unter dem Titel Ueber eine neue organische Basis in thierischen Organismen in Justus Liebigs Annalen der Chemie veröffentlicht.[4] Spermin und Spermidin prägen den typischen Geruch von Sperma.[5]
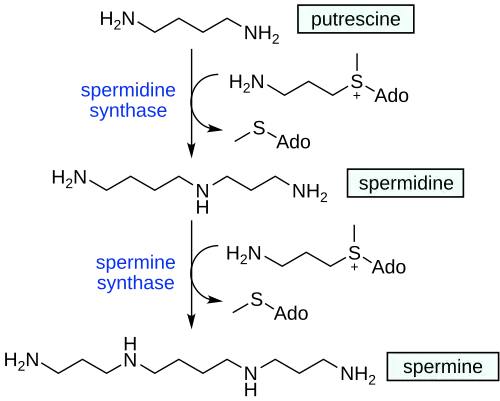
Katabolismus und Interkonversion
Die Decarboxylierung von Ornithin, katalysiert durch die Ornithindecarboxylase, ist nicht der einzige Entstehungsweg von Putrescin in tierischem Gewebe. Das zelluläre Spermin wird zurückverwandelt in Spermidin, das selbst weiter zu Putrescin abgebaut wird. Verantwortlich für diesen kontrollierten Katabolismus sind das Enzym Spermin/Spermidin-N1-acetyltransferase (SSAT) sowie das peroxysomale, FAD-abhängige Enzym Polyamin Oxidase (PAO).[6] Dabei wird zunächst das primäre Amin der Propylgruppe zum N1-Acetylspermidin/(-spermin) acetyliert; anschließend wird unter oxidativer Abspaltung von Acetamidopropanal Putrescin/(Spermidin) freigesetzt. Während die Aktivität der PAO in den meisten Körperzellen hoch ist, unterliegt die Aktivität der SSAT hormoneller Kontrolle und variiert in Abhängigkeit von der zellulären Polyaminkonzentration. In Anbetracht der kritischen Rolle der Polyamine für normales und neoplastisches[7] Zellwachstum ist die SSAT mit zuständig für eine angepasste Polyamin-Homöostase und sie kontrolliert den Polyamin-Stoffwechsel.[8] Die SSAT ist deshalb der geschwindigkeitsbestimmende Schritt beim zellulären Abbau der Polyamine.[9] Das so wiedergewonnene Putrescin steht in der Zelle für die Neusynthese von Spermidin und Spermin ebenso zur Verfügung wie das aus Ornithin ebenfalls in Abhängigkeit von der Polyaminkonzentration neu gebildete Putrescin. Man spricht deshalb von einem „Interkonversions-Zyklus“ der Polyamine.[6] Beim oxidativen Abbau der N1-Acetylpolyamine durch PAO entsteht außerdem H2O2. Vermehrter Polyaminabbau durch eine deregulierte, erhöhte SSAT-Aktivität setzt die Zelle unter oxidativen Stress. Eine wie SSAT induzierbare Spermin-Oxidase (SMOX) kann den oxidativen und potentiell mutagenen Stress noch zusätzlich verstärken. Diese Effekte können durch den begleitenden Verbrauch von zellulärem Acetyl-Coenzym A außerdem noch potenziert werden.[10] Andererseits sind Spermidin und Spermin in der Lage, eukarionte Zellen vor Sauerstoffradikalen zu schützen.[10]
Biochemische und physiologische Wirkung
Spermidin kommt in allen lebenden Organismen und in allen Körperzellen vor und ist eng mit dem Zellwachstum verbunden. Seine physiologische Funktion als Polykation in wachsenden Zellen ist die Stabilisierung von räumlichen Strukturen der Ribo- und Desoxyribonukleinsäuren und von Proteinen.[8][11][12] Die Menge von Spermidin im Organismus erhöht sich bei einer Beschleunigung des Stoffwechsels. Bei einer Verlangsamung des Stoffwechsels geht die Produktion von Spermidin zurück. Die Verringerung der Polyaminsynthese durch spezifische Hemmung der Ornithindecarboxylase führt zu einem Wachstumsstopp von Krebszellen und Tumoren.[13]
Spermidin induziert die Autophagozytose durch Enzymhemmung der Acetyltransferase EP300.[14] Als weitere potentielle Mechanismen wurden unter anderem transkriptionelle Effekte,[15] eine Stabilisierung des mikrotubuli-assoziierten Proteins 1S[16] sowie eine Modulierung des mTOR-Signalwegs[17] beschrieben.
Vorkommen beim Menschen
Im Blut Erwachsener schwankt die Konzentration von Spermidin im Mittel zwischen 6,56 und 10,3 µmol/l (0,95 und 1,5 mg/l).[18] „Spermin und Spermidin können nicht in allen Plasmaproben nachgewiesen werden.“[19] Zum Vergleich: Der Spermidingehalt in menschlichem Samenplasma (zellfreies Ejakulat) beträgt 15 bis 50 mg/l (Mittelwert 31 mg/l).[20] Im Sperma beträgt die Spermidin-Konzentration etwa 14,5 mg/l.
SARS-CoV-2
Virologen der Charité Berlin um Christian Drosten konnten zeigen, dass in humanen Lungenzellen, die mit SARS-CoV-2 infiziert waren, sowohl die Spermidinkonzentration als auch die Autophagocytose vermindert ist.[21] In Gegenwart von zugesetztem Spermidin war die Viruslast der Zellen um 85 % reduziert. Weiterhin konnten die Forscher zeigen, dass gesunde, mit Spermidin vorbehandelte Zellen, vor einer Infektion geschützt waren. Die Virusvermehrung war in diesen Zellen um 70 % reduziert. Den Autoren zufolge bieten sich damit neue Ansätze für Therapie und Prävention.[21] Bislang fehlen allerdings aussagekräftige Studien an Menschen, und es ist nicht bekannt, ob sich wirksame Gewebekonzentrationen durch die orale Zufuhr von Spermidin praktisch überhaupt erreichen lassen.[22]
Autophagocytose
Spermidin wirkt verstärkend auf die Autophagozytose, einen zellulären Prozess, der für die allgemeine Zellaktivität von Proteinen sowie für die Funktion der Mitochondrien und Kardiomyozyten (Herzmuskelzellen) wesentlich ist.[23][24] In Mäusen konnte gezeigt werden, dass Spermidin vor kardiovaskulären Erkrankungen schützt und damit zur Lebensverlängerung beitragen kann.[25] Es verzögert die Herzalterung, indem es die diastolische Funktion verbessert. Im Tierversuch wurde gezeigt, dass Hypertonie, ein wesentlicher Verursacher von Herzinsuffizienz, durch Spermidin gesenkt wird. Spermidin verringerte dabei die pulmonale bzw. systemische Flüssigkeitsansammlung, die für Herzinsuffizienz charakteristisch ist. Bei den Versuchen wurde auch eine protektive Wirkung auf die Nierenfunktion erkannt. Die Aufnahme von Spermidin in entsprechender Ernährung korrelierte umgekehrt zum Vorkommen der Herzinsuffizienz. In den Untersuchungsgruppen (Hoch- bzw. Niedrigaufnahme) war das Erkrankungsrisiko der Hochaufnahmegruppe um 40 Prozent reduziert.
Die Konzentration an körpereigenem Spermidin nimmt zudem beim Altern ab.[26] „Spermidin induziert bei Hefen, Fliegen und Würmern eine durch Autophagie vermittelte Verlängerung der Lebenserwartung. Der Spermidinspiegel sinkt im Laufe des Lebens bei fast allen Organismen, auch dem Menschen; ausgenommen sind davon nur die Hundertjährigen. Die orale Gabe von Spermidin und die Heraufregulation der bakteriellen Polyaminproduktion im Darm verlängern die Lebenserwartung in Mausmodellen.“[27]
An einer internationalen klinischen Untersuchung über einen zwanzigjährigen Beobachtungszeitraum (1995–2015) nahmen 829 zwischen 45 und 84 Jahre alte Menschen (Männeranteil bei 50 Prozent) teil. Dabei wurde die Aufnahme von Spermidin in den Ernährungsgewohnheiten dieser Personengruppe regelmäßig protokolliert. In diesem Zeitraum starben 341 der Personen, und zwar 40,5 Prozent von ihnen im unteren Drittel der Spermidinaufnahme, 24 Prozent im mittleren und 15 Prozent im oberen Drittel. Damit hatten die Probanden mit der höchsten Nahrungsaufnahme von Spermidin ein um 5,7 Jahre verlängertes Leben im Vergleich zur Gruppe mit der geringsten Aufnahme. Nach Korrektur für Alter, Geschlecht und Kalorienzufuhr betrug das Mortalitätsrisiko im Verhältnis noch 48, 41 und 38 Prozent.[28]
Im Tierversuch an Fruchtfliegen hatte sich gezeigt, dass eine Zufuhr von Spermidin durch die Nahrung bei diesen Insekten einer experimentellen Demenz entgegenwirkt.[26] (Originalartikel[29]) In einer 2018 durchgeführten randomisierten kontrollierten Studie konnte gezeigt werden, dass eine Spermidin-Supplementation über einen Zeitraum von drei Monaten bei der Behandlungsgruppe die Gedächtnisleistung moderat verbesserte.[30]
Die vorhandenen wissenschaftlichen Belege reichen allerdings nicht aus, um spermidinhaltigen Nahrungsergänzungsmitteln beim Menschen einen Nutzen zur Prophylaxe von Alterserscheinungen zuzuschreiben.[31][32] Auch die Verbraucherzentrale sieht einen Mangel von Nachweisen für den gewünschten Longevity-Effekt und warnt vor zu hohen Erwartungen bei einseitiger Ernährung.[33]
Verträglichkeit und Nebenwirkungen
In einer dreimonatigen Phase-II-Studie mit einem Pflanzenextrakt, der reich an Spermidin war, konnte bei einer Dosis von 1,2 mg pro Tag eine gute Verträglichkeit an älteren kognitiv beeinträchtigten Menschen festgestellt werden.[34] Im Vergleich dazu liegen im Tiermodell Farbmaus die Dosen, bei denen ein Autophagie-stimulierender Effekt gemessen werden konnte, bei 50 mg/kg Körpergewicht und intraperitonealer Verabreichung. Bei einem Zehntel der Dosis war dieser Effekt erheblich schwächer ausgeprägt.[35]
Vorkommen in Nahrungsmitteln
Nahrungsmittel mit hohem Spermidingehalt sind Vollkorn bzw. Weizenkeime, gereifter Käse, Pilze, Sojaprodukte und Hülsenfrüchte.[36] Spermidin kommt außer in tierischem Gewebe auch in Hefen vor.[37]
| Nahrungsmittel | Spermidin mg/kg |
Anmerkungen |
|---|---|---|
| Weizenkeime | 243 | [38] |
| Sojabohnen, getrocknet | 207 | Japan[36] |
| Cheddarkäse, 1 Jahr gereift | 199 | UK[36] |
| Sojabohnen, getrocknet | 128 | Deutschland[36] |
| Kürbiskerne | 104 | Österreich |
| Pilze | 89 | Japan[36] |
| Reiskleie | 50 | [36] |
| Hühnerleber | 48 | [36] |
| Erbsen | 46 | [36] |
| Mango | 30 | [36] |
| Kichererbsen | 29 | [36] |
| Blumenkohl (gekocht) | 25 | [36] |
| Brokkoli (gekocht) | 25 | [36] |
Weblinks
- Jungbleiben mit Spermidin? Die Verbraucherzentrale zu Spermidin-Supplementen. Auf: klartext-nahrungsergaenzung.de vom 27. April 2022; zuletzt abgerufen am 9. Januar 2023.
Literatur
- Jinu Kim: Spermidine rescues proximal tubular cells from oxidative stress and necrosis after ischemic acute kidney injury. In: Archives of Pharmacal Research. Oktober 2017, Band 40, Nr. 10, S. 1197–1208, doi:10.1007/s12272-017-0957-3.
- Vorkommen von Putrescine, Spermidin und Spermin in Nahrungsmitteln: M. Atiya Ali, E. Poortvliet, R. Strömberg, A. Yngve: Polyamines in foods: development of a food database. In: Food & nutrition research. Band 55, 2011, doi:10.3402/fnr.v55i0.5572. PMID 21249159. PMC 3022763 (freier Volltext).
- Erkenntnisse über die Rolle und Mechanismen von Spermidin bei Alterung und altersbedingten Krankheiten: You-Shuo Liu Yu-Qing Ni, You-Shuo Liu Yu-Qing Ni: New Insights into the Roles and Mechanisms of Spermidine in Aging and Age-Related Diseases. In: Aging and disease. 2021, Band 12, Nr. 8, S. 1948–1963, doi:10.14336/AD.2021.0603.
- Sabrina Schroeder, Sebastian J. Hofer, Andreas Zimmermann, Raimund Pechlaner, Christopher Dammbrueck, Tobias Pendl, G. Mark Marcello, Viktoria Pogatschnigg, Martina Bergmann, Melanie Müller, Verena Gschiel, Selena Ristic, Jelena Tadic, Keiko Iwata, Gesa Richter, Aitak Farzi, Muammer Üçal, Ute Schäfer, Michael Poglitsch, Philipp Royer, Ronald Mekis, Marlene Agreiter, Regine C. Tölle, Péter Sótonyi, Johann Willeit, Barbara Mairhofer, Helga Niederkofler, Irmgard Pallhuber, Gregorio Rungger, Herbert Tilg, Michaela Defrancesco, Josef Marksteiner, Frank Sinner, Christoph Magnes, Thomas R. Pieber, Peter Holzer, Guido Kroemer, Didac Carmona-Gutierrez, Luca Scorrano, Jörn Dengjel, Tobias Madl, Simon Sedej, Stephan J. Sigrist, Bence Rácz, Stefan Kiechl, Tobias Eisenberg, Frank Madeo: Dietary spermidine improves cognitive function. In: Cell Reports. Band 35, Nr. 2, 13. April 2021, Artikel: 108985, DOI:10.1016/j.celrep.2021.108985.
Einzelnachweise
- ↑ a b c d e Datenblatt Spermidine bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- ↑ Celia White Tabor und Herbert Tabor: Polyamines. In: Annual Reviews of Biochemistry. Nr. 53, 1984, S. 749–790.
- ↑ Anthony E. Pegg: Introduction to the Thematic Minireview Series: Syxty plus years of polyamine research. In: Journal of Biological Chemistry. Band 293, Nr. 48, 2018, S. 18681–18692, doi:10.1074/jbc.TM118.006291 (englisch).
- ↑ Philipp Schreiner: Ueber eine neue organische Basis in thierischen Organismen. In: Justus Liebigs Annalen der Chemie. Band 194, 1878, S. 68–84, doi:10.1002/jlac.18781940107.
- ↑ Linus S. Geisler: Lexikon Medizin. Das Nachschlagewerk für Ärzte, Apotheker, Patienten. 4., neubearbeitete und erweiterte Auflage. Lexikon-Redaktion Elsevier GmbH München, Sonderausgabe, Naumann & Göbel Verlagsgesellschaft, Köln ohne Jahr [2005], ISBN 3-625-10768-6, S. 1568.
- ↑ a b Nikolaus Seiler, Frank N. Bolkenius und Bernd Knödgen: The influence of catabolic reactions on polyamine excretion. In: Biochemical Journal. Band 225, Nr. 1, 1985, S. 219–226, doi:10.1042/bj2250219.
- ↑ Eugene W. Gerner und Frank L. Meyskens: Polyamines and cancer: old molecules, new understanding. In: Nature Reviews Cancer. Band 4, Nr. 10, 1. Oktober 2004, S. 781–792, doi:10.1038/nrc1454.
- ↑ a b J. Jänne et al.: Genetic approaches to the cellular functions of polyamines in mammals. In: FEBS (Hrsg.): European Journal of Biochemistry. Nr. 271, 2004, S. 877–894, doi:10.1111/j.1432-1033.2004.04009.x.
- ↑ Anthony E. Pegg: Spermidine/spermine-N1-acetyltransferase: a key metabolic regulator. In: American Journal of Physiology-Endocrinology and Metabolism. Band 294, 2008, S. E995-E1010, doi:10.1152/ajpendo.90217.2008.
- ↑ a b Tracy Murray Stewart, Tiffany T. Dunston, Patrick M. Woster, and Robert A. Casero, Jr.: Polyamine catabolism and oxidative damage. Band 293, Nr. 48, 17. Oktober 2018, S. 18736–18745, doi:10.1074/jbc.TM118.003337.
- ↑ Kazuei Igarashi, Keiko Kashiwagi: Modulation of cellular function by polyamines. In: The International Journal of Biochemistry & Cell Biology. Band 42, 2010, S. 39, doi:10.1016/j.biocel.2009.07.009.
- ↑ Swati Mandal, Ajeet Mandal, Hans E. Johansson, Arturo V. Orjalo, Myung Hee Park: Depletion of cellular polyamines, spermidine and spermine, causes a total arrest in translation and growth in mammalian cells. In: Proceedings of the National Academy of Sciences. Band 110, 2013, S. 2169, doi:10.1073/pnas.1219002110.
- ↑ F.L. Meyskens, E.W. Gerner: Development of Difluoromethylornithine (DFMO) as a Chemopreventive Agent. In: Clinical Cancer Research. Band 5, Mai 1999, S. 945–951, PMID 10353725.
- ↑ F. Pietrocola, S. Lachkar, D. P. Enot, M. Niso-Santano, J. M. Bravo-San Pedro, Valentina Sica, Valentina Izzo, Maria Chiara Maiuri, F. Madeo, G. Mariño, Guido Kroemer: Spermidine induces autophagy by inhibiting the acetyltransferase EP300. In: Cell Death and Differentiation. Band 22, Nr. 3, März 2015, S. 509–516, doi:10.1038/cdd.2014.215, PMID 25526088, PMC 4326581 (freier Volltext).
- ↑ Spermidine, an autophagy inducer, as a therapeutic strategy in neurological disorders. In: Neuropeptides. Band 83, 1. Oktober 2020, S. 102083, doi:10.1016/j.npep.2020.102083.
- ↑ Pengfei Liu, Montserrat Rojo de la Vega, Matthew Dodson, Fei Yue, Boyun Shi: Spermidine Confers Liver Protection by Enhancing NRF2 Signaling Through a MAP1S-Mediated Noncanonical Mechanism. In: Hepatology (Baltimore, Md.). Band 70, Nr. 1, Juli 2019, S. 372–388, doi:10.1002/hep.30616, PMID 30873635, PMC 6597327 (freier Volltext).
- ↑ Jing Yan, Jian‐Yun Yan, Yu‐Xi Wang, Yuan‐Na Ling, Xu‐Dong Song: Spermidine‐enhanced autophagic flux improves cardiac dysfunction following myocardial infarction by targeting the AMPK/mTOR signalling pathway. In: British Journal of Pharmacology. Band 176, Nr. 17, September 2019, S. 3126–3142, doi:10.1111/bph.14706, PMID 31077347, PMC 6692641 (freier Volltext) – (englisch).
- ↑ Cornelius Lentner, Ciba-Geigy (Hrsg.): Wissenschaftliche Tabellen Geigy. 2. Physikalische Chemie, Blut, Humangenetik, Stoffwechsel und Xenobiotika. 8. Auflage, Ciba-Geigy-Verlag, Basel 1979, S. 94. - Dortige Quellen: Buhl, Häcker, in: Roswitha Winter, Hedi Friedemann: Diagnostische Enzymologie (= Ergebnisse der Experimentellen Medizin. Band 12). Verlag Volk und Gesundheit, Berlin 1973, OCLC 827734266, S. 86. – Außerdem: Tallack Thompson In: Gordon et alii: Malignant Hyperthermia. Thomas, Springfield (Ill.) 1973, OCLC 181787952, S. 309.
- ↑ Cornelius Lentner, Ciba-Geigy (Hrsg.): Wissenschaftliche Tabellen Geigy. 2. Physikalische Chemie, Blut, Humangenetik, Stoffwechsel und Xenobiotika. 8. Auflage, Basel 1979, S. 96.
- ↑ Sperma. In: Ciba-Geigy (Hrsg.): Wissenschaftliche Tabellen Geigy / [1], [Teilband Körperflüssigkeiten: Einheiten im Messwesen, Körperflüssigkeiten, Organe]. 8., revidierte und erweiterte Auflage. Ciba-Geigy-Verlag, Basel 1977, OCLC 310588254, S. 181–189.
- ↑ a b Nils C. Gassen, Christian Drosten, Marcel A. Müller et al.: Analysis of SARS-CoV-2-controlled autophagy reveals spermidine, MK-2206, and niclosamide as putative antiviral therapeutics. In: BioRxiv. 15. April 2020, bioRxiv: 10.1101/2020.04.15.997254v1 (Preprint-Volltext).
- ↑ Martin Smollich: Charité-Studie: Mit Spermidin gegen COVID-19. In: Ernährungsmedizin. 23. April 2020, abgerufen am 23. April 2020.
- ↑ Frank Madeo et al.: Induction of autophagy by spermidine promotes longevity. In: US National Library of Medicine National Institutes of Health (Hrsg.): Nature Cell Biology,. 11. November 2009, S. 1305–1314, doi:10.1038/ncb1975, PMID 19801973.
- ↑ Sabrina Schroeder, Andreas Zimmermann, Didac Carmona-Gutierrez, Tobias Eisenberg, Christoph Ruckenstuhl, Aleksandra Andryushkova, Tobias Pendl, Alexandra Harger, Frank Madeo: Metabolites in aging and autophagy. In: Microbial Cell. Band 1, Nr. 4, April 2014, S. 110–114, doi:10.15698/mic2014.04.142 (PDF).
- ↑ Frank Madeo et al.: Cardioprotection and lifespan extension by the natural polyamine spermidine. In: Nature Medicine. 22. Dezember 2016, S. 1428–1438, doi:10.1038/nm.4222, PMID 27841876.
- ↑ a b Verabreichung der natürlichen Substanz Spermidin stoppt Demenz. Freie Universität Berlin, 1. September 2013, abgerufen am 4. September 2013.
- ↑ Rafael de Cabo, David G. le Couteur: Die Biologie des Alterns. In: Tinsley Randolph Harrison: Harrisons Innere Medizin. 20. Auflage, Thieme, Berlin 2020, ISBN 978-3-13-243524-7, 4. Band, Kapitel 236, S. 4228–4235, Zitat S. 4234 f.
- ↑ Stefan Kiechl, Raimund Pechlaner, Peter Willeit, Marlene Notdurfter, Bernhard Paulweber, Karin Willeit, Philipp Werner, Christoph Ruckenstuhl, Bernhard Iglseder, Siegfried Weger, Barbara Mairhofer, Markus Gartner, Ludmilla Kedenko, Monika Chmelikova, Slaven Stekovic, Hermann Stuppner, Friedrich Oberhollenzer, Guido Kroemer, Manuel Mayr, Tobias Eisenberg, Herbert Tilg, Frank Madeo, Johann Willeit: Higher spermidine intake is linked to lower mortality: a prospective population-based study. In: The American Journal of Clinical Nutrition. Band 108, Nr. 2, 1. August 2018, S. 371–380, doi:10.1093/ajcn/nqy102, PMID 29955838.
- ↑ Varun K Gupta, Lisa Scheunemann, Tobias Eisenberg, Sara Mertel, Anuradha Bhukel, Tom S Koemans, Jamie M Kramer, Karen S Y Liu, Sabrina Schroeder, Hendrik G Stunnenberg, Frank Sinner, Christoph Magnes, Thomas R Pieber, Shubham Dipt, André Fiala, Annette Schenck, Martin Schwaerzel, Frank Madeo, Stephan J Sigrist: Restoring polyamines protects from age-induced memory impairment in an autophagy-dependent manner. In: Nature Neuroscience. 1. September 2013, doi:10.1038/nn.3512 (englisch).
- ↑ Miranka Wirth, Gloria Benson, Claudia Schwarz, Theresa Köbe, Ulrike Grittner, Dietmar Schmitz, Stephan J. Sigrist, Jens Bohlken, Slaven Stekovic, Frank Madeo, Agnes Flöel: The effect of spermidine on memory performance in older adults at risk for dementia: A randomized controlled trial. In: Cortex. Band 109, Dezember 2018, S. 181–188, doi:10.1016/j.cortex.2018.09.014 (Epub: 4. Oktober 2018).
- ↑ ANTI-AGING MIT SPERMIDIN? 20. Mai 2020, abgerufen am 8. Januar 2023.
- ↑ Jana Meixner: Spermidin: Anti-Aging-Effekt unklar. In: Medizin transparent. 11. März 2024, abgerufen am 5. April 2024.
- ↑ Jungbleiben mit Spermidin? Abgerufen am 16. August 2025.
- ↑ Claudia Schwarz, Slaven Stekovic, Miranka Wirth, Gloria Benson, Philipp Royer, Stephan J. Sigrist, Thomas Pieber, Christopher Dammbrueck, Christoph Magnes, Tobias Eisenberg, Tobias Pendl, Jens Bohlken, Theresa Köbe, Frank Madeo, Agnes Flöel: Safety and tolerability of spermidine supplementation in mice and older adults with subjective cognitive decline. In: Aging. Band 10, Nr. 1, Januar 2018, S. 19–33, doi:10.18632/aging.101354, PMID 29315079, PMC 5807086 (freier Volltext).
- ↑ Eugenia Morselli, Guillermo Mariño, Martin V. Bennetzen, Tobias Eisenberg, Evgenia Megalou, Sabrina Schroeder, Sandra Cabrera, Paule Bénit, Pierre Rustin, Alfredo Criollo, Oliver Kepp, Lorenzo Galluzzi, Shensi Shen, Shoaib Ahmad Malik, Maria Chiara Maiuri, Yoshiyuki Horio, Carlos López-Otín, Jens S. Andersen, Nektarios Tavernarakis, Frank Madeo, Guido Kroemer: Spermidine and resveratrol induce autophagy by distinct pathways converging on the acetylproteome. In: Journal of Cell Biology. Band 192, Nr. 4, Februar 2011, S. 615–629, doi:10.1083/jcb.201008167, PMID 21339330, PMC 3044119 (freier Volltext).
- ↑ a b c d e f g h i j k l Mohamed Atiya Ali, Eric Poortvliet, Roger Strömberg, Agneta Yngve: Polyamines in foods: development of a food database. In: Food & Nutrition Research. Band 55, Nr. 1, 1. Januar 2011, S. 5572, doi:10.3402/fnr.v55i0.5572, PMID 21249159, PMC 3022763 (freier Volltext).
- ↑ Günter Thiele, Heinz Walter (Hrsg.): Reallexikon der Medizin und ihrer Grenzgebiete. Urban & Schwarzenberg, Loseblattsammlung 1966–1977, 6. Ordner (S–Zz), München / Berlin / Wien 1974, ISBN 3-541-84006-4, S. S 252.
- ↑ T. M. Klein, T. Gradziel, M. E. Fromm, J. C. Sanford: Factors Influencing Gene Delivery into Zea Mays Cells by High–Velocity Microprojectiles. In: Nature Biotechnology. Band 6, Nr. 5, S. 559–563, doi:10.1038/nbt0588-559.
