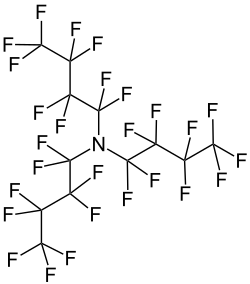
Perfluortributylamin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Perfluortributylamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12F27N | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 671,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,883 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt |
−52 °C[2] | ||||||||||||||||||
| Siedepunkt |
178 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | ||||||||||||||||||
| Brechungsindex |
1,2890 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Perfluortributylamin (PFTBA) ist eine Flüssigkeit aus der Gruppe der Perfluorcarbone,[5] welche in der Atmosphäre den Treibhauseffekt stark fördert.
Eigenschaften
Perfluortributylamin ist eine wasserunlösliche und chemisch inerte, farblose Flüssigkeit. Forscher der Universität Toronto stellten fest, dass PFTBA als Gas das 7100-fache Treibhauspotential von Kohlendioxid besitzt. Da es nur in Spuren in der Atmosphäre vorkommt, ist seine Gesamtwirkung hingegen nur 1/10.000 so groß wie die von Kohlendioxid.[6]
Es ist strukturell eng verwandt mit Perfluamin, das statt perfluorierten Butylgruppen perfluorierte Propylgruppen aufweist.
Verwendung
PFTBA wird unter anderem in der Elektronikindustrie (Handelsname z. B. Fluorinert FC-43 von 3M) für Hitzetests[3] und früher / anfänglich etwa 1990 bis 1995 beim Dampfphasenlöten[7] eingesetzt, welches aber zwischenzeitlich durch nicht klimaaktives Perfluorpolyether abgelöst wurde. Ebenfalls findet es in der Massenspektrometrie als Kalibriersubstanz Verwendung.[8] Ein Massenspektrum und eine Tabelle mit exakten Massen zur Kalibrierung von Massenspektrometern ist als Referenz zugänglich[9]. Zubereitungen, die Perfluortributylamin (z. B. Fluosol) und andere Perfluorcarbone enthalten, eignen sich als Blut- und Erythrozytenersatz[5] und werden auch in der Augenmedizin[10] und in Partikelzählern in Flugzeugen[11] eingesetzt.
Weblinks
- Forscher entdecken fieses Treibhausgas PFTBA. Tausendfach schädlicher als CO2. Focus Online, 11. Dezember 2013.
- Neuer Klimakiller entdeckt. Gefährliche Treibhausgase. Berliner Zeitung, 11. Dezember 2013.
Einzelnachweise
- ↑ a b Datenblatt Perfluorotributylamine, Mass Spec Std bei Alfa Aesar, abgerufen am 14. Dezember 2013 (Seite nicht mehr abrufbar).
- ↑ a b c d e f g h Datenblatt Perfluortributylamin (PFTBA) bei Sigma-Aldrich, abgerufen am 1. August 2025 (PDF).
- ↑ a b 3M: Electronic Liquid FC-43
- ↑ S. Gangolli, Royal Society of Chemistry (Great Britain): The Dictionary of Substances and Their Effects: O–S. Royal Society of Chemistry, 1999, ISBN 0-85404-833-2, S. 175 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Franz von Bruchhausen, Hermann Hager, Siegfried Ebel, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis: Stoffe L–Z. Springer DE, 1999, ISBN 3-642-58388-1, S. 407 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Angela C. Hong, Cora J. Young, Michael D. Hurley, Timothy J. Wallington, Scott A. Mabury: Perfluorotributylamine: A novel long-lived greenhouse gas. In: Geophysical Research Letters. 40, 2013, S. 6010–6015, doi:10.1002/2013GL058010.
- ↑ Howard H. Manko: Soldering Handbook For Printed Circuits and Surface Mounting. Springer, 1995, ISBN 0-442-01206-3, S. 239 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jürgen H. Gross, Karin Beifuss: Massenspektrometrie: Ein Lehrbuch. Springer DE, 2013, ISBN 3-8274-2981-1, S. 110 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans-Joachim Hübschmann: Handbook of GC-MS. 3. Auflage. Wiley-VCH, Weinheim, Germany 2015, ISBN 978-3-527-33474-2, S. 319 ff.
- ↑ Alain Tressaud, Günter Haufe: Fluorine and Health: Molecular Imaging, Biomedical Materials and Pharmaceuticals. Elsevier, 2008, ISBN 0-08-055811-9, S. 410 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Manfred Wendisch, Jean-Louis Brenguier: Airborne Measurements for Environmental Research: Methods and Instruments. John Wiley & Sons, 2013, ISBN 978-3-527-65324-9, S. 166 (eingeschränkte Vorschau in der Google-Buchsuche).