Boronsäureester
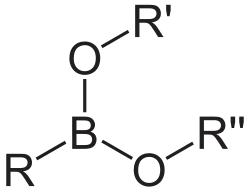
Boronsäureester oder Organoboronsäureester sind eine Stoffgruppe der organischen Chemie und eine Untergruppe der Bororganischen Verbindungen. Es handelt sich um die Ester der Boronsäuren.
Herstellung
Boronsäureester können durch direkte Veresterung von Boronsäuren mit Alkoholen gewonnen werden. Beispielsweise können Ester der Phenylboronsäure wie Ethylenphenylboronat, Propylenphenylboronat oder Brenzcatechinphenylboronat durch Erhitzen von Phenylboronsäure mit dem entsprechenden Alkohol in Toluol gewonnen werden.[1] Im Allgemeinen binden Boronsäuren leicht Diole unter Bildung von Boronsäureestern. Je nach pH-Wert und Lösungsmittel kann die Reaktion aber auch leicht wieder umgekehrt werden.[2]
Arylchloride können mit Bispinacolatodibor sowie (Bis(diphenylphosphin)ferrocen)palladium(II)-chlorid als Katalysator direkt in entsprechende Boronsäureester mit Pinakol als Alkoholkomponente überführt werden.[3] Analog können diverse Heteroaromaten wie Thiophen, Furan, Pyrrol und Pyridin mit Bispinacolatodibor und einem Iridium-Katalysator zu entsprechenden Boronsäureestern umgesetzt werden.[4] Bei solchen Borylierungen treten Iridium-Boryl-Komplexe als Intermediate auf. Ein solcher konnte in einer Studie isoliert werden und ermöglichte die effiziente Borylierung von Aromaten bei Raumtemperatur.[5]
Reaktionen
Ein enorm wichtiger Anwendungsbereich von Boronsäureestern – weit überwiegend mit Pinakol als Alkoholkomponente – sind Suzuki-Miyaura-Kupplungen. Die ursprünglichen Reagenzien hierfür waren Brenzcatechin-Boronsäureester, die von Boronsäuren verdrängt wurden, die wiederum von den Pinakol-Boronsäureestern verdrängt wurden. Dies hängt unter anderem mit der leichten synthetischen Zugänglichkeit dieser Edukte zusammen.[6]
Ester der Phenylboronsäure wie Ethylenphenylboronat, Propylenphenylboronat oder Diisopropylphenylboronat wirken unter Katalyse mit Kupfer(II)-acetat als Phenylierungsmittel und können zur Herstellung von Phenylaminen und Phenylethern verwendet werden.[1] Aromatische Boronsäureester des Pinakols können ebenso wie die freien Boronsäuren mit Hydroxylamin bei Raumtemperatur zu Phenolen umgesetzt werden.[7]
Boronsäureester können durch Homologisierung mit Dichlormethyllithium zum hochstereoselektiven Aufbau von verzweigten Kohlenstoffketten und sekundären Alkoholen verwendet werden.[8] Beispielsweise wurden Boronsäureester mit Pinandiol als Alkoholkompomponente für solche Reaktionen verwendet. Dazu wird der Ester zunächst bei −100 °C mit Dichlormethyllithium umgesetzt, was ein vierfach substituiertes Borat ergibt. Dieses lagert sich durch Reaktion mit Zinkchlorid wieder zu einem Boronsäureester um, der in α-Position ein Chloratom trägt, welches durch eine Organolithiumverbindung oder Grignard-Verbindung substituiert werden kann, um variable Verzweigungen aufzubauen. Der so erhaltene Boronsäureester kann erneut in der gleichen Weise umgesetzt werden, um Verbindungen mit mehreren konsekutiven Stereozentren aufzubauen. Die Methode wurde für die Synthese von Insektenpheromonen eingesetzt: (3S,4S)-4-Methyl-3-heptanol (Pheromon von Hylurgopinus rufipes, einem Borkenkäfer), exo-Brevicomin (Pheromon von Dendroctonus brevicomis, ebenfalls ein Borkenkäfer) und Eldanolid (Pheromon von Eldana saccharina, einem Zünsler).[9]
Einzelnachweise
- ↑ a b Dominic M.T. Chan, Kevin L. Monaco, Renhua Li, Damien Bonne, Charles G. Clark, Patrick Y.S. Lam: Copper promoted C–N and C–O bond cross-coupling with phenyl and pyridylboronates. In: Tetrahedron Letters. Band 44, Nr. 19, Mai 2003, S. 3863–3865, doi:10.1016/S0040-4039(03)00739-1.
- ↑ Greg Springsteen, Binghe Wang: A detailed examination of boronic acid–diol complexation. In: Tetrahedron. Band 58, Nr. 26, Juni 2002, S. 5291–5300, doi:10.1016/S0040-4020(02)00489-1.
- ↑ Tatsuo Ishiyama, Miki Murata, Norio Miyaura: Palladium(0)-Catalyzed Cross-Coupling Reaction of Alkoxydiboron with Haloarenes: A Direct Procedure for Arylboronic Esters. In: The Journal of Organic Chemistry. Band 60, Nr. 23, November 1995, S. 7508–7510, doi:10.1021/jo00128a024.
- ↑ Jun Takagi, Kazuaki Sato, John F Hartwig, Tatsuo Ishiyama, Norio Miyaura: Iridium-catalyzed C–H coupling reaction of heteroaromatic compounds with bis(pinacolato)diboron: regioselective synthesis of heteroarylboronates. In: Tetrahedron Letters. Band 43, Nr. 32, August 2002, S. 5649–5651, doi:10.1016/S0040-4039(02)01135-8.
- ↑ Tatsuo Ishiyama, Jun Takagi, Kousaku Ishida, Norio Miyaura, Natia R. Anastasi, John F. Hartwig: Mild Iridium-Catalyzed Borylation of Arenes. High Turnover Numbers, Room Temperature Reactions, and Isolation of a Potential Intermediate. In: Journal of the American Chemical Society. Band 124, Nr. 3, 1. Januar 2002, S. 390–391, doi:10.1021/ja0173019.
- ↑ Phillip A. Inglesby, Lauren R. Agnew, Holly L. Carter, Oliver T. Ring: Diethanolamine Boronic Esters: Development of a Simple and Standard Process for Boronic Ester Synthesis. In: Organic Process Research & Development. Band 24, Nr. 9, 18. September 2020, S. 1683–1689, doi:10.1021/acs.oprd.0c00296.
- ↑ Ebrahim Kianmehr, Maryam Yahyaee, Katayoun Tabatabai: A mild conversion of arylboronic acids and their pinacolyl boronate esters into phenols using hydroxylamine. In: Tetrahedron Letters. Band 48, Nr. 15, April 2007, S. 2713–2715, doi:10.1016/j.tetlet.2007.02.069.
- ↑ Donald S. Matteson: Boronic Esters in Asymmetric Synthesis. In: The Journal of Organic Chemistry. Band 78, Nr. 20, 18. Oktober 2013, S. 10009–10023, doi:10.1021/jo4013942.
- ↑ Donald S. Matteson, Kizhakethil Mathew. Sadhu, Mark L. Peterson: 99% Chirally selective synthesis via pinanediol boronic esters: insect pheromones, diols, and an amino alcohol. In: Journal of the American Chemical Society. Band 108, Nr. 4, Februar 1986, S. 810–819, doi:10.1021/ja00264a039.