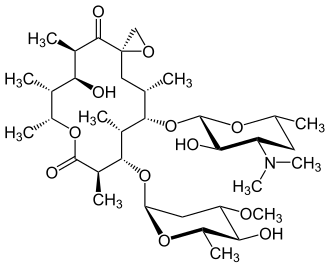
Oleandomycin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Oleandomycin[1] | |||||||||||||||||||||
| Andere Namen |
(3R,5R,6S,7R,8R,11R,12S,13R, 14S,15S)-12-(2,6-Didesoxy-3-O-methyl-α-ʟ-arabino-hexopyranosyloxy)-6-hydroxy-5,7,8,11,13,15-hexamethyl-14-(3,4,5-tridesoxy-3-dimethylamino-β-ᴅ-xylo-hexopyranosyloxy)-1,9-dioxaspiro[2.13]hexadecan-4,10-dion | |||||||||||||||||||||
| Summenformel | C35H61NO12 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 687,9 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Oleandomycin ist ein natürlich vorkommendes Makrolid-Antibiotikum aus Streptomyces antibioticus.
Vorkommen und Biosynthese
Oleandomycin wird von Streptomyces antibioticus gebildet. Der makrocyclische Lactonring wird aus einer Einheit Acetyl-CoA und sechs Einheiten Methylmalonyl-CoA gebildet. Die beiden Zuckereinheiten, L-Oleandrose und D-Desosamin werden durch zwei Glycosyltransferasen übertragen. Die Epoxid-Einheit wird durch ein Cytochrom-P450-Enzym synthetisiert.[3] Ein wahrscheinlicher Vorläufer der Oleandrose ist wiederum eine aktivierte Form von Olivose, dem nichtmethylierten Analog von Oleandrose.[4] Streptomyces antibioticus selbst ist immun gegen Oleandomycin, was vermutlich auf der Bildung eines Enzyms basiert, das die Verbindung durch Glucosylierung inaktivieren kann. wobei UDP-Glucose als Quelle für die Glucose dient. Ein weiteres Enzym kann Oleandomycin reaktivieren. Der Mechanismus der Inaktivierung funktioniert auch bei einigen anderen Antibiotika mit strukturell ähnlichen Zucker-Einheiten wie Methymycin, Rosaramicin und Lankamycin.[5]
Eigenschaften und Verwendung
Oleandomycin gehört zu den „kleinen Makrolidantibiotika“ (12 bis 18 Ringglieder) und reagiert wie andere Vertreter dieser Gruppe mit der S50-Untereinheit bakterieller Ribosomen. Es unterbindet die Translokation der tRNA von der Aminoacyl-tRNA-Bindungsstelle zur Peptidyl-tRNA-Bindungsstelle und beeinträchtigt die Proteinsynthese.[6] Das Wirkspektrum ist relativ schmal und umfasst hauptsächlich gram-positive Bakterien sowie gram-positive und gram-negative Kokken.[6] Das Wirkungsspektrum entspricht dem des Erythromycins,[7] jedoch ist die antimikrobielle Aktivität vergleichsweise geringer.[8] Oleandomycin zeigt Kreuzresistenz zu Erythromycin.[9] Der fixen Kombination von Tetracyclin mit Oleandomycin 2:1 (Präparatename Sigmamycin) wurde eine synergistische Wirkung zugeschrieben, die in vitro nur für wenige Keime[10] bzw. nicht[9][8] bestätigt werden konnte.Sigmamycin war in Deutschland, auch in der Pädiatrie,[11] für die Behandlung verschiedener bakterieller Infektionskrankheiten verfügbar.[9] Die pharmazeutisch eingesetzte Form ist das Oleandomycinphosphat. Eine weitere Anwendungsform ist der Triacetatester Troleandomycin.[12]
Präparate
In der EU sind nur zwei in Bulgarien zugelassene tiermedizinische Präparate für Hund und Katzen verfügbar: Oletetpacort aerosol (Kombination mit Tetracyclin und Hydrocortisonacetat) und Tetraolenadomycin Tabletten (Kombination mit Tetracyclin), letztere auch für Fohlen.[13] Da der Wirkstoff nicht in der VO (EU) Nr. 37/2010 gelistet ist, darf er bei Lebensmittel liefernden Tieren nicht eingesetzt werden.
Einzelnachweise
- ↑ INN Recommended List 03. In: who.int. 9. Dezember 1959, abgerufen am 20. Mai 2025 (englisch).
- ↑ a b c d Datenblatt (3R,5R,6S,7R,14S)-12-[(2,6-DIDEOXY-3-O- METHYL-ALPHA-L-GLYCERO- HEXOPYRANOSYL)OXY]-6-HYDROXY- 5,7,8,11,13,15-HEXAMETHYL-4,10-DIOXO- 1,9-DIOXASPIRO[2.13]HEXADEC-14-YL 3,4,6-TRIDEOXY-3-(DIMETHYLAMINO)-D- GLYCERO-HEXOPYRANOSIDE bei Sigma-Aldrich, abgerufen am 19. Mai 2025 (PDF).
- ↑ Leticia Rodrı́guez, David Rodrı́guez, Carlos Olano, Alfredo F. Braña, Carmen Méndez, José A. Salas: Functional Analysis of OleY l -Oleandrosyl 3- O -Methyltransferase of the Oleandomycin Biosynthetic Pathway in Streptomyces antibioticus. In: Journal of Bacteriology. Band 183, Nr. 18, 15. September 2001, S. 5358–5363, doi:10.1128/JB.183.18.5358-5363.2001, PMID 11514520, PMC 95419 (freier Volltext).
- ↑ Ignacio Aguirrezabalaga, Carlos Olano, Nerea Allende, Leticia Rodriguez, Alfredo F. Braña, Carmen Méndez, José A. Salas: Identification and Expression of Genes Involved in Biosynthesis of l -Oleandrose and Its Intermediate l -Olivose in the Oleandomycin Producer Streptomyces antibioticus. In: Antimicrobial Agents and Chemotherapy. Band 44, Nr. 5, Mai 2000, S. 1266–1275, doi:10.1128/AAC.44.5.1266-1275.2000, PMID 10770761, PMC 89854 (freier Volltext).
- ↑ C Vilches, C Hernandez, C Mendez, J A Salas: Role of glycosylation and deglycosylation in biosynthesis of and resistance to oleandomycin in the producer organism, Streptomyces antibioticus. In: Journal of Bacteriology. Band 174, Nr. 1, Januar 1992, S. 161–165, doi:10.1128/jb.174.1.161-165.1992, PMID 1530845, PMC 205690 (freier Volltext).
- ↑ a b E. Teuscher: Biogene Arzneimittel. 5. Auflage. Wissenschaftliche Verlagsgesellschaft, 1997, ISBN 3-8047-1482-X, S. 452.
- ↑ A. M. Walter: Neue Antibiotika. In: DMW - Deutsche Medizinische Wochenschrift. 1956, Band 81, Nummer 50, S. 1992–1997. doi:10.1055/s-0028-1115276.
- ↑ a b L. P. Garrod: The Erythromycin Group of Antibiotics. In: BMJ. 1957, Band 2, Nummer 5036, S. 57–63. doi:10.1136/bmj.2.5036.57, PMC 1961747 (freier Volltext).
- ↑ a b c Johannes Meyer-Rohn: Neuere Antibiotika. In: DMW - Deutsche Medizinische Wochenschrift. 1962, Band 87, Nummer 35, S. 1724–1731. doi:10.1055/s-0028-1114011.
- ↑ R. W. Fairbrother, J. E. Southall: In-vitro activity of sigmamycin: a combination of tetracycline and oleandomycin. In: The Lancet. Band 273, Nummer 7003, November 1957, S. 974–976, doi:10.1016/s0140-6736(57)92001-9, PMID 13482262.
- ↑ P. Schweier: Klinische Erfahrungen mit Sigmamycin in der Pädiatrie. In: Chemotherapy. 1960, Band 1, Nummer 2, S. 120–126 doi:10.1159/000219400.
- ↑ Präparate Mastalone, Oleandocyn, Sigmamycin u. a. In: PharmNet.Bund-Arzneimittel-Informationssystem, abgerufen am 20. Mai 2025.
- ↑ Oleandomycin. Produktdatenbank der EU. Abgerufen am 20. Mai 2025.