Norcoclaurin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
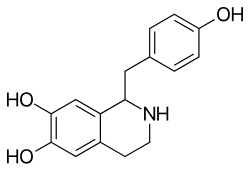
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Norcoclaurin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C16H17NO3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 271,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt |
260–262 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Norcoclaurin oder Higenamin ist eine organische Verbindung und ein Alkaloid aus der Gruppe der Benzylisochinolin-Alkaloide.
Biosynthese und biologische Bedeutung
Norcoclaurin wird aus Tyrosin gebildet und ist ein Intermediat in der Biosynthese vieler weiterer Alkaloide, konkret der Benzylisochinolin-Alkaloide.[3] Es ist der direkte Vorläufer in der Biosynthese von Coclaurin, welches wiederum ein Vorläufer von Papaverin und Reticulin ist. Von Reticulin aus führen mehrere Biosynthesewege zum Morphin, Noscapin, Berberin und Sanguinarin.[4] Weitere Beispiele sind Thebain, Tetrandrin, Magnoflorin und Tubocurarin.[3]
Synthese
Racemisches Norcoclaurin
Norcoclaurin kann durch Demethylierung von natürlichem Coclaurin mit Bromwasserstoffsäure gewonnen werden. Eine Totalsynthese ausgehend von 4-Methoxyphenylessigsäure wurde 1984 publiziert. Diese wird zunächst mit Thionylchlorid zum 4-Methoxyphenylacetylchlorid umgesetzt, dann mit 3,4-Dimethoxyphenethylamin zu einem Carbonsäureamid. Die Tetrahydroisochinolinstruktur wird durch Bischler-Napieralski-Reaktion mit Phosphoroxychlorid und anschließende Reduktion mit Natriumborhydrid aufgebaut. Die Demethylierung der drei Methoxygruppen mit konzentrierter Iodwasserstoffsäure ergibt racemisches Norcoclaurin. Eine weitere Synthese geht von Tyrosin aus, welches zunächst mit Natriumhypochlorit in Phosphatpuffer zum 4-Hydroxyphenylacetaldehyd umgesetzt wird. Dieses kondensiert mit Dopaminhydrochlorid zum Norcoclaurin.[3]
Enantiomerenreines Norcoclaurin
Die erste enantioselektive Synthese ging von racemischem Armepavin aus. Die Enantiomere wurden durch Reaktion mit (S)-1-Phenylethylisocyanat in trennbare Diastereomere überführt. Durch Hydrolyse der separierten Verbindungen mit Natriumbutanolat und anschließende Demethylierung mit Bromwasserstoffsäure können die beiden Enantiomere des Norcoclaurins als Hydrobromid erhalten werden. Eine neuere Synthese verwendet eine Noyori-Hydrierung als Schlüsselschritt. Dabei wird zunächst 4-Methoxyphenylessigsäure durch Erhitzen auf 200 °C mit 3,4-Dimethoxyphenethylamin kondensiert. Das erhaltene Intermediat wird in einer Bischler-Napieralski-Reaktion mit Phosphoroxychlorid zu einem Dihydroisochinolin cyclisiert. Die darin enthaltene Iminogruppe wird dann mit Ameisensäure enantioselektiv reduziert, wobei als Katalysator (S,S)-N-Tosylethylendiamin(p-Cymol)Ruthenium(I)-chlorid verwendet wird. Die so erhaltene Verbindung kann mit Bromwasserstoff in Essigsäure in das Hydrobromid überführt und dann mit Bortribromid in Dichlormethan zum Norcoclaurin-Hydrobromid demethyliert werden. Die enzymatische Synthese gelingt beispielsweise ausgehend von Tyrosin und Dopamin mit Natriumhypochlorit in Phosphatpuffer mit einer Norcoclaurin-Synthase aus Thalictrum flavum. Auch die Trennung der Enantiomere aus racemischem Norcoclaurin ist möglich. So kann das Racemat mit 4-(3-isothiocyanatopyrrolidin-1-yl)-7-(N,N-dimethylaminosulfonyl)-2,1,3-benzoxadiazol derivatisiert und die erhaltenen Diastereomere chromatographisch getrennt werden. Andererseits ist auch die direkte chromatographische Trennung auf einer chiralen Säule möglich.[3]
Einzelnachweise
- ↑ a b Encyclopedia of Traditional Chinese Medicines. Springer Berlin Heidelberg, ISBN 978-3-642-16738-6, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Cayman Chemical: (±)-Higenamine (hydrochloride) ((±)-Demethylcoclaurine, Norcoclaurine, CAS Number: 11041-94-4), abgerufen am 8. Juni 2025
- ↑ a b c d Francesca Ghirga, Deborah Quaglio, Patrizio Ghirga, Simone Berardozzi, Giovanni Zappia, Bruno Botta, Mattia Mori, Ilaria D'Acquarica: Occurrence of Enantioselectivity in Nature: The Case of ( S )‐Norcoclaurine. In: Chirality. Band 28, Nr. 3, März 2016, S. 169–180, doi:10.1002/chir.22566.
- ↑ Jillian M. Hagel, Jeremy S. Morris, Eun-Jeong Lee, Isabel Desgagné-Penix, Crystal D. Bross, Limei Chang, Xue Chen, Scott C. Farrow, Ye Zhang, Jung Soh, Christoph W. Sensen, Peter J. Facchini: Transcriptome analysis of 20 taxonomically related benzylisoquinoline alkaloid-producing plants. In: BMC Plant Biology. Band 15, Nr. 1, Dezember 2015, doi:10.1186/s12870-015-0596-0, PMID 26384972, PMC 4575454 (freier Volltext).

