Lithiumamalgam
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Li _ Hg | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Lithiumamalgam | ||||||||||||
| Verhältnisformel | HgLi | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 207,6 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
9,238 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Lithiumamalgam ist eine intermetallische chemische Verbindung des Lithiums aus der Gruppe der Amalgame. Neben LiHg sind auch noch weitere Verbindungen des Lithiums aus dieser Gruppe bekannt, darunter LiHg5, LiHg3 und Li3Hg.[1][5][6] Von diesen ist LiHg die stabilste Verbindung.[7]
Gewinnung und Darstellung
Lithiumamalgam kann auch durch Elektrolyse von Lithiumhydroxid- oder Lithiumchlorid-Lösungen mit einer Quecksilber-Kathode hergestellt werden, wobei eine Isotopenseparation mit einem Faktor von 1,056 auftritt.[8][9]
Lithiumamalgame können durch Reaktion von Lithium mit Quecksilber bei Temperaturen über 200 bis 300 °C gewonnen werden.[10][11]
Eigenschaften
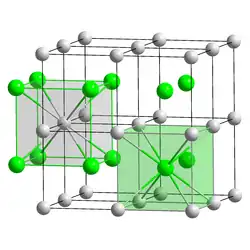
Lithiumamalgam ist ein Feststoff mit einer kubische Kristallstruktur vom Caesiumchlorid-Typ mit der Raumgruppe Pm3m (Raumgruppen-Nr. 221).[12]
Verwendung
Es wurde wegen seiner potenziellen Verwendung als Lasermedium umfassend mit Molekularstrahlstreuungsexperimenten, ab-initio-Berechnungen und lasergestützter Spektroskopie untersucht.[13]
Lithiumamalgame eignen sich zur Durchführung intramolekularer und intermolekularer Kupplungsreaktionen vom Wurtz-Typ. Sie können auch bei der Synthese von Cycloalkanen wie Bicyclo[1.1.1]pentan[14] eingesetzt und Octamethyltricyclo[4.2.0.02,5]octa-3,7-dien[S 1] verwendet werden.[15][10] In der Literatur sind weitere Beispiele für seine erfolgreiche Verwendung in der organischen Synthese beschrieben.[11]
Einzelnachweise
- ↑ a b F. I. Shamraĭ: Lithium and Its Alloys. U.S. Atomic Energy Commission, Technical Information Service Extension, 1962, S. 110 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Yan Wang, Chun-Mei Hao, Hong-Mei Huang, Yan-Ling Li: Elastic, dynamical, and electronic properties of LiHg and Li3Hg: First-principles study. In: Frontiers of Physics. Band 13, Nr. 2, 2017, S. 137102, doi:10.1007/s11467-017-0723-5.
- ↑ Handbook of Solid State Chemistry, 6 Volume Set. Wiley, ISBN 978-3-527-32587-0, S. 61 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Indagoo: MSDS Lithium, compd. with mercury (1:1), abgerufen am 14. März 2025.
- ↑ Inorganic Reactions and Methods, The Formation of Bonds to Group-I, -II, and -IIIB Elements. Wiley, ISBN 0-470-14549-8, S. 313 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Metals in Mercury. Pergamon, Amsterdam 1986, ISBN 978-0-08-023921-7, Lithium, Sodium, Potassium, Rubidium, Cesium, S. 1–54, doi:10.1016/b978-0-08-023921-7.50008-9.
- ↑ Handbook on Rare Earth Metals and Alloys (Properties, Extraction, Preparation and Applications). NIIR Project Consultancy Services, ISBN 978-81-7833-120-1, S. 262 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Makoto FUJIE, Yasuhiko FUJII, Masao NOMURA, Makoto OKAMOTO: Isotope Effects in Electrolytic Formation of Lithium Amalgam. In: Journal of Nuclear Science and Technology. Band 23, Nr. 4, 1986, S. 330–337, doi:10.1080/18811248.1986.9734990.
- ↑ K. Okuyama, I. Okada, N. Saito: The isotope effects in the isotope exchange equilibria of lithium in the amalgam-solution system. In: Journal of Inorganic and Nuclear Chemistry. Band 35, Nr. 8, 1973, S. 2883–2895, doi:10.1016/0022-1902(73)80520-2.
- ↑ a b G. J. Żukowsky: Über Lithiumamalgame. In: Zeitschrift für anorganische Chemie. Band 71, Nr. 1, 1911, S. 403–418, doi:10.1002/zaac.19110710135.
- ↑ a b Jose Alexander, G. S. Krirshna Rao: Preparation of lithium amalgam. In: Journal of Chemical Education. Band 47, Nr. 4, 1970, S. 277, doi:10.1021/ed047p277.
- ↑ Rainer Pöttgen, Dirk Johrendt: Intermetallics. De Gruyter, 2014, ISBN 978-3-486-85618-7, S. 214 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Yan Wang, Chun-Mei Hao, Hong-Mei Huang, Yan-Ling Li: Elastic, dynamical, and electronic properties of LiHg and Li3Hg: First-principles study. In: Frontiers of Physics. Band 13, Nr. 2, 2017, S. 137102, doi:10.1007/s11467-017-0723-5.
- ↑ Daniel S. Connor, Eugene R. Wilson: Ring closures via the Wurtz reaction a convenient synthesis of cyclobutane. In: Tetrahedron Letters. Band 8, Nr. 49, 1967, S. 4925–4929, doi:10.1016/S0040-4039(01)89939-1.
- ↑ Rudolf Criegee, Gerd Louis: Über Ein Dimeres des Tetramethyl-Cyclobutadiens. In: Chemische Berichte. Band 90, Nr. 3, 1957, S. 417–424, doi:10.1002/cber.19570900320.
