Isoharnstoffe
| Isoharnstoffe |
|---|
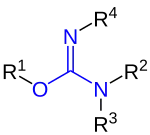
|
| R sind organische Reste (Alkyl, Aryl o. ä.) oder Wasserstoffatome. |
Isoharnstoffe, auch Carbamimidate, sind eine Stoffgruppe der organischen Chemie. Sie sind isomer zu Harnstoffen, weisen im Gegensatz zu diesen aber eine C=N-Doppelbindung und eine C-O-Einfachbindung auf.
Herstellung
Isoharnstoffe werden insbesondere aus Imidoderivaten der Kohlensäure hergestellt. So ist beispielsweise die Umsetzung eines Imidokohlensäureesters mit einem Amin möglich, ebenso die Umsetzung eines entsprechenden Monohalogenids. Ein Beispiel hierfür ist die Reaktion von Methyl-N-Phenylchlorformamimidat mit Dimethylamin. Auch die umgekehrte Variante, das heißt die Umsetzung eines Halogenid-Amids mit einem Alkoholat ergibt Isoharnstoffe.[1] Daneben ist auch die Addition eines Alkohols an ein Cyanamid möglich, wobei ein Isoharnstoff mit unsubstituierter Iminofunktion erhalten wird. Umgekehrt kann auch ein Amin an ein organisches Cyanat addiert werden.[2]
Eine weitere Synthesemethode ist die Reaktion von Carbodiimiden mit Alkoholen, insbesondere in Gegenwart von Kupfer(I)-chlorid. Diese Reaktion eignet sich auch zur Aktivierung des Alkohols. Beispielsweise kann enantiomerenreines 2-Octanol mit Dicyclohexylcarbodiimid umgesetzt werden. Durch Hydrolyse kann dann der Alkohol unter Inversion des Stereozentrums zurückgewonnen werden. Harnstoffe können durch Alkylierung mit Meerwein-Salzen in Isoharnstoffe überführt werden.[1] Andere Alkylierungsmittel, die diese Reaktion ermöglichen sind Dialkylsulfate, Sulfonate und Alkyliodide.[2]
Eigenschaften und Reaktionen
Isoharnstoffe sind deutlich stärkere Basen als Harnstoffe. Die Verbindungen sind reaktiv gegenüber Nucleophilen, wirken aber selbst auch als Nucleophile und können leicht am Stickstoffatom acyliert werden. Isoharnstoffe wirken als Alkylierungsmittel und können eine Organylgruppe von ihrem Sauerstoff übertragen. So können beispielsweise Alkohole zu Ethern umgesetzt werden, wobei als Nebenprodukt ein Harnstoff anfällt. Auch eine analoge Alkylierung von Chlorwasserstoff, Bromwasserstoff und Iodwasserstoff ist möglich, welche Alkylhalogenide ergibt. Mit Aminen können Isoharnstoffe zu Guanidinen umgesetzt werden. N-Alkylisoharnstoffe können durch Hydrierung über Palladium zu Alkanen reduziert werden. Analog ist die Reduktion von O-Arylisoharnstoffen zu aromatischen Kohlenwasserstoffen möglich. Durch Erhitzen in Xylol am Rückfluss können Isoharnstoffe zu den entsprechenden Harnstoffen isomerisiert werden.[2]
Verwendung
Einige Isoharnstoffe werden als Pflanzenschutzmittel und in der medizinischen Chemie eingesetzt.[2]
Einzelnachweise
- ↑ a b Alan R. Katritzky, Thomas L. Gilchrist, Otto Meth-Cohn, Charles Wayne Rees: Comprehensive Organic Functional Group Transformations. Elsevier, 2003, ISBN 978-0-08-042704-1, S. 631–633 (google.de [abgerufen am 2. September 2025]).
- ↑ a b c d Abdigali A Bakibaev, V V Shtrykova: Isoureas: synthesis, properties, and applications. In: Russian Chemical Reviews. Band 64, Nr. 10, 31. Oktober 1995, S. 929–938, doi:10.1070/RC1995v064n10ABEH000185.