Hypervalenz
Als Hypervalenz [griech. hyper: über, zu viel, siehe Liste griechischer Präfixe] wird die positive Abweichung zur Valenzstrukturtheorie bezeichnet, nach der die äußere Schale eines Atoms mehr als die nach der Edelgaskonfiguration von s- und p-Orbitalen möglichen acht Elektronen aufnehmen kann (Oktettregel). Sie tritt bei Verbindungen von schweren Hauptgruppenelementen der 3. bis 8. Hauptgruppe mit starken Elektronenakzeptoren wie Sauerstoff oder Fluor auf.[1] So zum Beispiel in Selenhalogeniden wie Selenhexafluorid (SeF6) oder Iodfluoriden (z. B. IF5, IF7), generell in vielen Edelgas- und Interhalogenverbindungen. Es wurde eine Beteiligung der d-Orbitale des Zentralatoms angenommen, was allerdings inzwischen als nicht korrekt gilt. Heutzutage wird die Beschreibung durch eine elektronenreiche Mehrzentrenbindung realisiert.
Beispiele
Hypervalente Iodverbindungen
In der organischen Synthesechemie werden hypervalente Iodverbindungen als milde Oxidationsmittel vielfach eingesetzt.[2] Zu diesen „modernen“ Oxidationsmitteln zählen u. a:
| Iodosylbenzol[3][4] | Diacetoxyiodbenzol (DIB)[3][4][5] | Iodbenzoldichlorid[6][7] | Dess-Martin-Periodinan (DMP)[3][4] | 2-Iodoxybenzoesäure (IBX)[3][4][5] | 2-Iodosylbenzoesäure (IBA)[8] |
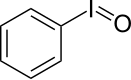 |

|

|
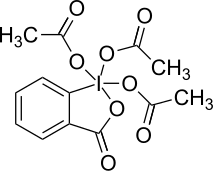 |
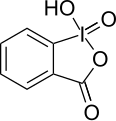
|
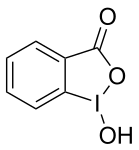
|
Dess-Martin-Periodinan wird besonders in der so genannten Dess-Martin-Oxidation eingesetzt. Weiterhin gibt es Reagenzien mit hypervalentem Iod, die zur elektrophilen Einführung von Iod (Angriff von I+ auf Nucleophile, z. B. C=C-Doppelbindungen) dienen:
| Di-sym-collidin-iodoniumperchlorat[9] |
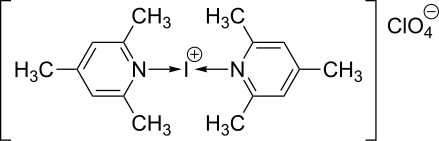
|
Einzelnachweise
- ↑ Eintrag zu hypervalency. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.HT07054 – Version: 2.3.2.
- ↑ Akira Yoshimura, Viktor V. Zhdankin: Advances in Synthetic Applications of Hypervalent Iodine Compounds. In: Chemical Reviews. Band 116, Nr. 5, 9. März 2016, ISSN 0009-2665, S. 3328–3435, doi:10.1021/acs.chemrev.5b00547.
- ↑ a b c d V. V. Zhdankin, P. J. Stang: In: Chemical Reviews. 102, 2002, S. 2523–2584.
- ↑ a b c d T. Wirth: In: Angew. Chem. 117, 2005, S. 3722–3731.
- ↑ a b R. D. Richardson, T. Wirth: In: Angew. Chem. 118, 2006, S. 4510–4512.
- ↑ E. M. Archer, T. G. van Schalkwyk: The crystal structure of benzene iododichloride. In: Acta Crystallographica. Band 6, Nr. 1, 1. Januar 1953, ISSN 0365-110X, S. 88–92, doi:10.1107/S0365110X53000193 (iucr.org [abgerufen am 11. Juni 2025]).
- ↑ J. V. Carey, P. A. Chaloner, P. B. Hitchcock, T. Neugebauer, K. R. Seddon: ChemInform Abstract: Synthesis and Decomposition of Dichloroiodoarenes. An Improved Low Temperature X-Ray Structure of Dichloroiodobenzene and the Structure of 1-Chloro-2,3,5,6-tetrakis(chloromethyl)-4-methylbenzene. In: ChemInform. Band 27, Nr. 52, 1996, ISSN 1522-2667, doi:10.1002/chin.199652032 (wiley.com [abgerufen am 11. Juni 2025]).
- ↑ Supanimit Chiampanichayakul, Manat Pohmakotr, Vichai Reutrakul, Thaworn Jaipetch, Chutima Kuhakarn: Oxidative Conversion of Amines into Their Corresponding Nitriles Using o -Iodoxybenzoic Acid (IBX)/Iodine: Selective Oxidation of Aminoalcohols to Hydroxynitriles. In: Synthesis. Band 2008, Nr. 13, 11. Juni 2008, ISSN 0039-7881, S. 2045–2048, doi:10.1055/s-2008-1067123 (thieme-connect.de [abgerufen am 3. September 2025]).
- ↑ D. A. Griffith, S. J. Danishefsky: In: J. Am. Chem. Soc. 112, 1990, S. 5811–5819.