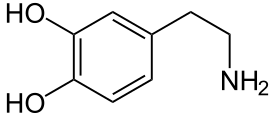
Dopamin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Dopamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H11NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Prismen, mit charakteristischem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C01CA04 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 153,18 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,93[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Dopamin (DA, Kunstwort aus DOPA und Amin) ist ein biogenes Amin aus der Gruppe der Katecholamine und ein wichtiger, überwiegend erregend wirkender Neurotransmitter des zentralen Nervensystems. Es wird für eine Vielzahl von lebensnotwendigen Steuerungs- und Regelungsvorgängen benötigt, bspw. verursacht es Motivation.
Dopamin wird auch als Arzneistoff verwendet, beispielsweise zur Behandlung des Herz-Kreislauf-Schocks.
Biosynthese
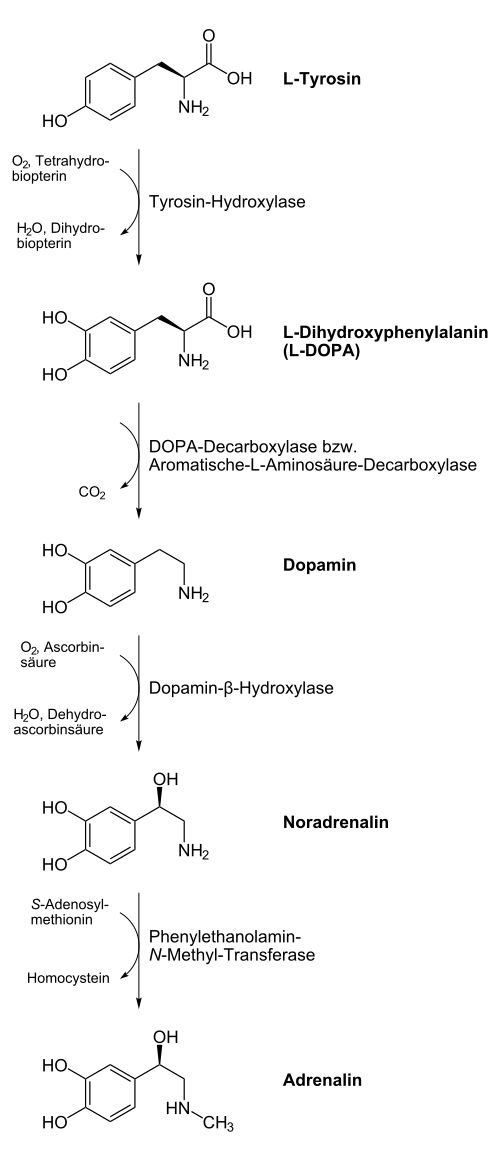
Dopamin ist ein Zwischenprodukt in der von der Aminosäure Tyrosin ausgehenden Biosynthese von Adrenalin. Tyrosin wird durch Tyrosinhydroxylase in Levodopa umgewandelt und dieses wiederum durch Aromatische-L-Aminosäure-Decarboxylase in Dopamin.
Dopamin ist unter anderem Baustein bei der Biosynthese von Isochinolinalkaloiden[4] z. B. des Berberins. Auch in tierischem Gewebe findet die Biosynthese von Morphin aus Dopamin über dieselben Zwischenstufen (Laudanosin, Reticulin und Thebain) wie in Pflanzen statt. Dies konnte anhand verschiedener Zellkulturen nachgewiesen werden.[5]
Physiologie
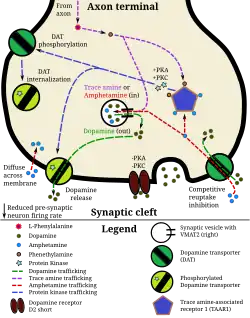
Nervenzellen, in denen Dopamin vorkommt, werden dopaminerg genannt. Dopaminerge Neuronen befinden sich im Zentralnervensystem (ZNS) und hier vor allem im Mittelhirn. Vom Mittelhirn aus steigen wichtige dopaminerge Systeme ins Endhirn und ins Zwischenhirn auf. Die zugehörigen Neuronenpopulationen finden sich in der Substantia nigra, in der Area tegmentalis ventralis und in den retro-rubralen Regionen. Dopamin ist aber auch ein Neurotransmitter in einigen Systemen des vegetativen Nervensystems und reguliert hier die Durchblutung innerer Organe. Es wird für eine Vielzahl von lebensnotwendigen Steuerungs- und Regelungsvorgängen benötigt.
Unter anderem beeinflusst Dopamin die extrapyramidale Motorik (hier besteht möglicherweise ein Zusammenhang mit der Parkinsonschen Erkrankung). Ebenso steht der Dopaminhaushalt im Zusammenhang mit der Neurobiologie von Psychosen und anderer Störungen. Auch in die Regulation des Hormonhaushaltes greifen dopaminerge Systeme ein. So hemmt Dopamin aus Neuronen, die entlang des 3. Hirnventrikels lokalisiert sind, an der Hypophyse die Ausschüttung des Hormons Prolaktin. Weiter regelt es die Durchblutung der Bauchorgane, insbesondere ist Dopamin an der Steuerung der Nieren beteiligt.
Dopamin verursacht auch Motivation.[6][7][8][9] Ihm wird daher auch eine wichtige Rolle bei Suchterkrankungen zugeschrieben. So kommt es beim Gebrauch der meisten Drogen zur Wirkungsverstärkung von Dopamin,[10] Serotonin und Gamma-Aminobuttersäure. Hierbei ist die Störung im Dopaminspiegel für einen Teil der Entzugssymptome verantwortlich.
Rezeptortypen
Die Wirkung einer Dopaminausschüttung durch eine präsynaptische Endigung auf das postsynaptische Neuron hängt vom Dopamin-Rezeptortyp in der Postsynapse ab. Zurzeit unterscheidet man fünf Dopamin-Rezeptoren (D1–D5). Bindet Dopamin an D1 oder D5, wird die nachgeschaltete Zelle depolarisiert (exzitatorisches postsynaptisches Potential). Eine Bindung an die Rezeptoren D2–D4 bewirkt eine Hyperpolarisierung der Postsynapse (inhibitorisches postsynaptisches Potential). Die letzteren Rezeptortypen werden zusammengefasst auch als D2-Gruppe bezeichnet. Es gibt zudem Hinweise darauf, dass Dopaminrezeptoren des Typs D1 und des Typs D2 sogenannte Heterodimere bilden können, was zu einer Aktivierung des Phospholipase-Signalwegs und schließlich einem Anstieg der intrazellulären Ca-Konzentration führt.[11] Die physiologische Bedeutung davon ist jedoch noch unklar.
Verarbeitungspfade
Im ZNS gibt es im Wesentlichen vier dopaminerge Verarbeitungspfade:
- Das Mesostriatale System (auch Nigro-Striatale System) nimmt seinen Ursprung in der Substantia nigra im Mittelhirn und projiziert v. a. zu den Basalganglien, die eine wichtige Rolle bei der Bewegungssteuerung spielen. Diesem Pfad wird eine wesentliche Rolle bei den hypokinetischen Symptomen bei Morbus Parkinson sowie den häufig auftretenden extrapyramidalen Störungen als Nebenwirkung von Neuroleptika zugeschrieben.
- Das mesolimbische System entspringt ebenfalls in der Area tegmentalis ventralis und projiziert v. a. zum limbischen System (Hippocampus, Amygdala, Corpus mamillare, Fornix usw.). Dieser Pfad trägt sehr wahrscheinlich wesentlich zu den sogenannten „positiven“ Symptomen bei schizophrenen Störungen bei. Es gilt als das „Belohnungssystem“, bei dessen Funktionsreduktion Patienten lust- und antriebslos werden (Anhedonie, oft bei Parkinsonpatienten). An diesem System setzt z. B. die intrakranielle Selbststimulation an, bei der Mäuse sich bis zur völligen Erschöpfung über implantierte Elektroden selbst stimulieren. Auch bestimmte Drogen, wie Kokain und Amphetamine, wirken auf dieses System.
- Das Mesocorticale System verläuft von der Area tegmentalis ventralis zum Frontallappen. Nach derzeitigem Verständnis hat das Funktionieren dieser Bahn eine Bedeutung für die sogenannten exekutiven Funktionen sowie die Motivation. Im Zusammenhang mit Psychosen des schizophrenen Formenkreises wird hier eine Unteraktivität gesehen, die man mit den mit diesen Erkrankungen oft einhergehenden kognitiven Störungen in Verbindung bringt.
- Das tuberoinfundibuläre System, dessen Neuronen vom Nucleus arcuatus zum Hypophysenvorderlappen ziehen und dort die Freisetzung von Prolactin hemmen.
Dopamin-assoziierte Erkrankungen
Störungen im dopaminergen System sind mit einer Vielzahl von Erkrankungen verbunden. Sie betreffen sowohl das Nervensystem als auch psychiatrische und endokrine Bereiche.
Morbus Parkinson
Bei der Parkinson-Krankheit gehen in der Substantia nigra des Mittelhirns nach und nach dopaminerge Nervenzellen zugrunde. Der daraus resultierende Dopaminmangel im Striatum führt zu den typischen Symptomen wie Tremor, Rigor und Verlangsamung der Bewegungen. Therapeutisch werden vor allem L-Dopa und Dopaminagonisten eingesetzt, um den Dopaminmangel auszugleichen.[12]
Restless-Legs-Syndrom
Das Restless-Legs-Syndrom wird mit Störungen im Dopamin- und Eisenstoffwechsel in Verbindung gebracht. Betroffene leiden unter Missempfindungen und einem Bewegungsdrang der Beine; beide Symptome verstärken sich vor allem in Ruhe und nachts. Als wirksam gelten dopaminerge Substanzen wie Pramipexol oder Ropinirol, die häufig zur Behandlung eingesetzt werden.[13]
Tourette-Syndrom
Beim Tourette-Syndrom gelten genetische Faktoren sowie Veränderungen in verschiedenen Neurotransmittersystemen als mögliche Ursachen. Eine Fehlregulation der dopaminergen Signalwege wird dabei besonders hervorgehoben, da sie mit dem Auftreten motorischer und vokaler Tics in Verbindung gebracht wird. Stress und innere Anspannung können die Symptome verstärken.[14]
Schizophrenie
Gemäß der Dopaminhypothese wird seit den 1960er Jahren ein übermäßig hoher Dopaminspiegel in bestimmten Hirnarealen mit Symptomen der Schizophrenie in Verbindung gebracht. Der Gebrauch stark dopaminerger Substanzen, wie Pramipexol oder Amphetamin, kann auch bei gesunden Personen psychotische Symptome hervorrufen. Als Wirkprinzip vieler Antipsychotika, die zur Behandlung von Schizophrenie eingesetzt werden, wird eine Blockade der Dopaminrezeptoren angenommen.[15] Neuere Arbeiten differenzieren die Hypothese, indem sie eine Überaktivität im mesolimbischen System und gleichzeitig eine verminderte Aktivität im präfrontalen Cortex beschreiben. Diese kombinierte Betrachtung gilt heute als die maßgebliche Weiterentwicklung der ursprünglichen Dopaminhypothese.[16]
Depression
Auch bei depressiven Störungen spielt das Dopaminsystem eine wichtige Rolle, insbesondere im Zusammenhang mit Anhedonie, also dem Verlust der Freude- und Belohnungsfähigkeit. Studien weisen darauf hin, dass es bei Betroffenen zu einer Unteraktivität der dopaminergen Bahnen kommt, die mit einer gestörten Regulation durch andere Hirnregionen verknüpft ist. Stressbelastungen können diese Veränderungen zusätzlich verstärken und führen in Tiermodellen zu einer verminderten Aktivität dopaminerger Nervenzellen. Diese Mechanismen erklären, warum depressive Menschen häufig ein stark eingeschränktes Erleben von Motivation und Belohnung aufweisen.[17]
ADHS
Bei ADHS wird eine Störung der Regulation von Dopamin im Gehirn angenommen. Betroffen sind insbesondere Strukturen wie das Striatum, die für Aufmerksamkeit, Motivation und Impulskontrolle wichtig sind. Diskutiert werden unterschiedliche Mechanismen: Einerseits könnte ein Dopaminmangel durch verminderte Ausschüttung vorliegen, andererseits eine überaktive Wiederaufnahme durch Transporterproteine, die den Botenstoff zu schnell aus dem synaptischen Spalt entfernen. Auch genetische Faktoren und frühe Stressbelastungen können zur Fehlregulation beitragen. Insgesamt deuten die Befunde darauf hin, dass bei ADHS je nach Subtyp verschiedene Veränderungen im Dopaminsystem auftreten können.[18]
Abhängigkeitserkrankungen
Bei der Entstehung von Sucht spielt das dopaminerge Belohnungssystem eine zentrale Rolle. Substanzen wie Alkohol, Nikotin oder Kokain, aber auch bestimmte Verhaltensweisen, können eine starke Dopaminausschüttung auslösen. Das Gehirn speichert diesen Effekt als besonders bedeutsam, sodass der Reiz immer wieder gesucht wird. Mit der Zeit kommt es zu einer Art Lernprozess, der das Verlangen nach der Substanz oder dem Verhalten verstärkt, auch wenn Betroffene die negativen Folgen erkennen. Neben dieser biologischen Grundlage tragen individuelle Faktoren wie Persönlichkeit, früh erlernte Muster und soziale Einflüsse zusätzlich zum Suchtrisiko bei.[19]
Sonstige Erkrankungen
Auch andere Krankheitsbilder stehen in Zusammenhang mit Dopamin. Eine Hyperprolaktinämie kann entstehen, wenn die normalerweise hemmende Wirkung von Dopamin auf die Prolaktinsekretion fehlt.[20] Spätdyskinesien treten als Nebenwirkung einer langfristigen Blockade dopaminerger Rezeptoren, insbesondere durch Antipsychotika, auf.[21] Zudem gibt es seltene genetische Störungen wie den Dopamin-β-Hydroxylase-Mangel, bei dem Dopamin nicht in Noradrenalin umgewandelt wird.[22]
Medizinische Verwendung
Dopamin senkt den peripheren Widerstand durch Gefäßerweiterung und vergrößert so das Herzzeitvolumen[23] und damit auch die glomeruläre Filtrationsrate. Die therapeutische Anwendung von Dopamin als Katecholamin bei Schockzuständen, bei sehr niedrigem Blutdruck oder beim Nierenversagen tritt jedoch zunehmend in den Hintergrund, da es neben offensichtlichen unerwünschten Wirkungen wie Herzrhythmusstörungen auch zur Immunsuppression und zu endokrinologischen Störungen kommt, die gerade bei der Behandlung schwerstkranker Patienten in der Intensivmedizin problematisch sind. So wurde 2001[24] von einer Anwendung von Dopamin zur Verhinderung oder zur Behandlung des akuten Nierenversagens in niedriger Dosierung („Nierendosis“) als wissenschaftlich unbegründet abgeraten.
Zur Behandlung von Parkinson, bei der es wegen des Unterganges der Zellen in der Substantia nigra zu einem Mangel an Dopamin in den Basalganglien kommt, und des Restless-Legs-Syndroms wird Levodopa (L-DOPA), ein Prodrug des Dopamins, gegeben. Dopamin selbst würde nicht ins Zentralnervensystem gelangen, da es die Blut-Hirn-Schranke nicht passieren kann. Aus L-DOPA wird in den Basalganglien über Decarboxylierung Dopamin gebildet (siehe Abbildung). Dies würde auch schon vor dem Einfluten ins ZNS geschehen, weshalb es notwendig ist, L-DOPA mit einer Substanz zu kombinieren, die das für die Decarboxylierung verantwortliche (Aromatische-L-Aminosäure-Decarboxylase) Enzym hemmt. Zumeist erfolgt eine galenische Aufarbeitung des L-DOPAs zu einem Kombinationspräparat mit einem Decarboxylasehemmer wie Carbidopa oder Benserazid. Da weder Carbidopa noch Benserazid im Gegensatz zu L-DOPA die Blut-Hirn-Schranke überwinden können, wird die Umwandlung zu Dopamin im ZNS nicht blockiert.
Arzneilich verwendet wird das wasserlösliche Dopaminhydrochlorid. Es wird ausschließlich intravenös mit einer indikationsabhängigen Dosierung von 2–30 µg/kg/min[25] angewendet.
Als Fertigarzneimittel ist Dopamin als Infusionslösungskonzentrat meist unter seinem generischen Namen im Handel, in Österreich gibt es ferner ein Präparat namens Giludop, in Italien Revivan.
Gesellschaftliche Rezeption
Dopamin wird umgangssprachlich häufig „Glückshormon“ genannt. In der Medizin hat diese Einstufung keine Bedeutung.
Auf Basis der Rolle von Dopamin bei Motivation und Sucht entstanden in den letzten Jahren Trends wie „Dopamin-Fasten“[26][27][28][29][30][31][32][33][34][35][36][37][38][39] und Digital Detox.
Siehe auch
Weblinks
- Ilka Lehnen-Beyel: Verwirrung unter Gehirnbotenstoffen. In: wissenschaft.de, 8. April 2005: „Bei der Verwendung von Antidepressiva gerät das Gleichgewicht zwischen Serotonin und Dopamin durcheinander.“
- Dopamine Modulation. In: Scholarpedia. (englisch, inkl. Literaturangaben)
Einzelnachweise
- ↑ a b c Eintrag zu Dopamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b c Eintrag zu Dopamine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Dopamine hydrochloride bei Sigma-Aldrich, abgerufen am 25. Juli 2025 (PDF).
- ↑ GW. Kirby: Biosynthesis of the morphine alkaloids. In: Science, 1967 Jan 13, 155(3759), S. 170–173, PMID 5332945.
- ↑ Chotima Poeaknapo, Jürgen Schmidt, Matthias Brandsch, Birgit Dräger, Meinhart H. Zenk: Endogenous formation of morphine in human cells. In: PNAS (Proc Natl Acad Sci USA), 2004 Sep 28; 101(39), S. 14091–14096, PMC 521124 (freier Volltext).
- ↑ Malenka RC, Nestler EJ, Hyman SE: Molecular Neuropharmacology: A Foundation for Clinical Neuroscience. 2nd Auflage. McGraw-Hill Medical, New York 2009, ISBN 978-0-07-148127-4, S. 147–48, 366–67, 375–76 (amerikanisches Englisch).
- ↑ Baliki MN, Mansour A, Baria AT, Huang L, Berger SE, Fields HL, Apkarian AV: Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain. In: The Journal of Neuroscience. 33. Jahrgang, Nr. 41, Oktober 2013, S. 16383–93, doi:10.1523/JNEUROSCI.1731-13.2013, PMID 24107968, PMC 3792469 (freier Volltext) – (amerikanisches Englisch).
- ↑ Wenzel JM, Rauscher NA, Cheer JF, Oleson EB: A role for phasic dopamine release within the nucleus accumbens in encoding aversion: a review of the neurochemical literature. In: ACS Chemical Neuroscience. 6. Jahrgang, Nr. 1, Januar 2015, S. 16–26, doi:10.1021/cn500255p, PMID 25491156, PMC 5820768 (freier Volltext) – (amerikanisches Englisch).
- ↑ Puglisi-Allegra S, Ventura R: Prefrontal/accumbal catecholamine system processes high motivational salience. In: Front. Behav. Neurosci. 6. Jahrgang, Juni 2012, S. 31, doi:10.3389/fnbeh.2012.00031, PMID 22754514, PMC 3384081 (freier Volltext) – (englisch).
- ↑ Christian Lüscher, Mark A. Ungless: The Mechanistic Classification of Addictive Drugs (2006).
- ↑ S. P. Lee, C. H. So u. a.: Dopamine D1 and D2 Receptor Co-activation Generates a Novel Phospholipase C-mediated Calcium Signal. In: Journal of Biological Chemistry. 279, 2004, S. 35671, doi:10.1074/jbc.M401923200.
- ↑ Morbus Parkinson: Hoffnung auf neue Therapien. In: Deutsche Gesellschaft für Parkinson und Bewegungsstörungen. 2025, abgerufen am 7. September 2025.
- ↑ Restless Legs Syndrom. In: Deutsche Gesellschaft für Neurologie. 25. Juni 2022, abgerufen am 7. September 2025.
- ↑ Ursachen des Tourette-Syndroms. In: Tourette-Gesellschaft Deutschland. 15. April 2024, abgerufen am 7. September 2025.
- ↑ Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4. S. 94.
- ↑ Oliver D. Howes, Shitij Kapur: The Dopamine Hypothesis of Schizophrenia: Version III—The Final Common Pathway. In: Schizophrenia Bulletin. März 2009, abgerufen am 7. September 2025 (englisch).
- ↑ Pierre Belujon, Anthony A. Grace: Dopamine System Dysregulation in Major Depressive Disorders. In: International Journal of Neuropsychopharmacology. 29. Juni 2017, abgerufen am 7. September 2025 (englisch).
- ↑ 10. ADHS – Störungen des Dopaminsystems. In: ADxS.org. Abgerufen am 7. September 2025.
- ↑ Wie entsteht eine Sucht? In: AOK-Gesundheitsmagazin. 5. September 2022, abgerufen am 7. September 2025.
- ↑ John D. Carmichael: Prolactinoma. In: MSD Manual. Juni 2025, abgerufen am 7. September 2025 (englisch).
- ↑ Brigitte M. Gensthaler: Deutetrabenazin: Neuer Wirkstoff gegen Spätdyskinesien. In: Pharmazeutische Zeitung. 23. Juni 2025, abgerufen am 7. September 2025.
- ↑ Jean-Michel Senard, Philippe Rouet: Dopamine beta-hydroxylase deficiency. In: Orphanet Journal of Rare Diseases. 30. März 2006, abgerufen am 7. September 2025 (englisch).
- ↑ Praxisbuch Dopaminstörungen, Diagnose und Therapie. Sandoz AG, Nürnberg ohne Jahr, S. 9.
- ↑ J. A. Kellum, M. Decker J.: Use of dopamine in acute renal failure: a meta-analysis. In: Critical Care Medicine. Band 29, 2001, S. 1526–1531.
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 44–48 und 76.
- ↑ Verzichten auf alles, was Freude bringt. In: Deutschlandfunk Nova. 2. Dezember 2019, abgerufen am 5. April 2022.
- ↑ Benjamin Esche: Das bringt Dopamin-Fasten wirklich, erschienen am 31. Januar 2020 bei quarks.de, abgerufen am 5. April 2022.
- ↑ A. Trevor Sutton of The Conversation: Is dopamine fasting the path to enlightenment, or just another celebrity thing? Philadelphia Inquirer, 24. Januar 2020, abgerufen am 24. Januar 2020 (englisch).
- ↑ Chris Stokel-Walker: Is 'dopamine fasting' Silicon Valley's new productivity fad? BBC Worklife, 16. November 2019, abgerufen am 22. August 2022 (englisch).
- ↑ Is dopamine fasting good for you? BBC Reel, 17. August 2022, archiviert vom am 22. August 2022; abgerufen am 22. August 2022 (englisch).
- ↑ Julie Fraga: Dopamine fasting: Would a hiatus from pleasure make us better at life? Mic magazine, 30. Dezember 2019, abgerufen am 24. Januar 2020 (englisch).
- ↑ Dopamine fasting: Misunderstanding science spawns a maladaptive fad. 26. Februar 2020 (englisch).
- ↑ John Grohol: Dopamine Fasting Probably Doesn't Work, Try This Instead. In: www.psychcentral.com. 13. November 2019, abgerufen am 28. Januar 2020 (englisch).
- ↑ Kim Krieger: Q&A: John Salamone On The ‘Dopamine Fasting’ Trend. University of Connecticut, 20. Januar 2020, abgerufen am 24. Januar 2020 (englisch).
- ↑ Yi Yang Fei, Peter Anto Johnson, Noor A.L. Omran, Austin Mardon, John Christy Johnson: Maladaptive or misunderstood? Dopamine fasting as a potential intervention for behavioral addiction. In: Lifestyle Medicine. 3. Jahrgang, Nr. 1, Januar 2022, doi:10.1002/lim2.54 (englisch).
- ↑ Ciara McCabe: The next big thing: Dopamine fasting: COMMENTARY -- An expert reviews the latest craze in Silicon Valley. Street Roots magazine, 3. Januar 2020, abgerufen am 24. Januar 2020 (englisch).
- ↑ Maria Coole: Dopamine fasting is apparently now a thing – so we looked into it. Marie Claire magazine, 10. Januar 2020, abgerufen am 24. Januar 2020 (englisch).
- ↑ Nellie Bowles: How to Feel Nothing Now, in Order to Feel More Later (Published 2019) In: The New York Times, 7. November 2019. Abgerufen am 17. Januar 2021 (englisch).
- ↑ Katie Way: 'Dopamine Fasting' Is the Newest 'Sounds Fake, but OK' Wellness Trend. In: www.vice.com. Abgerufen am 28. Januar 2020 (englisch).