Dimethylsulfid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
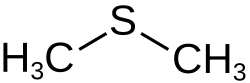
| Name | Dimethylsulfid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H6S | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 62,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,85 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
37 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4438 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
noch nicht eingestuft[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−65,3 kJ/mol[6] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Dimethylsulfid (DMS), auch Methylthiomethan ist eine schwefelhaltige organische Verbindung (also eines der Dialkylsulfide) mit der chemischen Formel (CH3)2S. Es ist der einfachste Thioether, die am häufigsten biogen in die Atmosphäre emittierte Schwefelverbindung und (neben anderen Verbindungen) verantwortlich für den typischen Geruch des Meeres. DMS entsteht unter anderem beim Kochen von verschiedenen Gemüsen, insbesondere Getreide und Kohl, sowie Meeresfrüchten. Außerdem dient es als Indikator für eine bakterielle Infizierung bei der Malzherstellung.[7] Dimethylsulfid ist ein Zersetzungsprodukt des Dimethylsulfoniumpropionats (DMSP), kann aber auch bei der bakteriellen Verstoffwechselung von Methanthiol entstehen.
Vorkommen
Geruchsstoff und Allelochemikalie
DMS ist weiterhin eine Komponente der Blähungsgase und von Mundgeruch im menschlichen Atem, es wird von anaeroben Bakterien im Mund- und Zungenbereich erzeugt.[8] Weiterhin gehört es zu den Duftstoffen des Perigord-Trüffels und mitverantwortlich für dessen Auffinden durch Trüffelhunde und Trüffelschweine.[9] Helicodiceros muscivorus (Familie Aronstabgewächse) nutzt Dimethylsulfid zusammen mit Dimethyldisulfid und Dimethyltrisulfid als Allomon, um Fliegen zur Bestäubung anzulocken.[10]
-
 Helicodiceros muscivorus
Helicodiceros muscivorus -
_(25817500456).jpg) Perigord-Trüffel
Perigord-Trüffel
Meer und Atmosphäre
DMS wird von Phytoplankton gebildet und ist in einigen nmol/l im Oberflächenwasser der Ozeane gelöst, wovon jährlich etwa 30 Millionen Tonnen in die Atmosphäre ausgasen.[11] Dort oxidiert DMS über Dimethylsulfoxid (DMSO) und Schwefeldioxid zu Schwefelsäure, die zu Tröpfchen kondensiert, also Aerosole bildet.[12] Auch Methansulfonsäure wird in der Atmosphäre aus Dimethylsulfid gebildet.[13] Krill frisst Phytoplankton und riecht daher nach DMS, was manche Nahrung suchende Seevögel wahrnehmen. Durch Bewuchs mit Phytoplankton riecht auch treibender Müll nach DMS und wird mit Krill verwechselt.[14]
Weltall
Die NASA gab am 12. September 2023 bekannt, dass bei der Untersuchung des Exoplaneten K2-18b möglicherweise DMS in der Atmosphäre gefunden wurde. Da das Vorkommen von DMS auf der Erde nur im Zusammenhang mit Leben bekannt ist, wird dies als möglicher Bioindikator für extraterrestrische Lebensformen diskutiert.[15] Spätere Untersuchungen relativierten diesen Befund und stellten die Möglichkeit, dass das James Webb Space Teleskop DMS tatsächlich detektiert hatte, in Frage.[16][17] 2025 wurde schließlich der Fund von Dimethylsulfid (und/oder Dimethyldisulfid) abermals bestätigt.[18]
Herstellung
DMS wird industriell mit Aluminiumoxid als Katalysator aus Schwefelwasserstoff und Methanol hergestellt.[19] Es fällt außerdem bei der Zellstoffherstellung nach dem Sulfatverfahren in der Papierindustrie in der Schwarzlauge als Nebenprodukt an.[20]
Dimethylsulfid ist ein Nebenprodukt bei Oxidationen von Alkoholen mit aktiviertem Dimethylsulfoxid, wozu beispielsweise die Pfitzner-Mofatt-Oxidation und die Swern-Oxidation gehören.[21]
Reaktionen
Dimethylsulfid wird in der Aufarbeitung bei der Ozonolyse von Alkenen genutzt, um Aldehyde und Ketone herzustellen. Die Reaktion ist schnell und die Weiterverarbeitung des Produktes in der Regel einfach. Wegen des unangenehmen Geruchs von Dimethylsulfid werden aber zum Teil andere Reduktionsmittel wie Thioharnstoff, Triphenylphosphin und Zink verwendet.[22] So wurde Dimethylsulfid beispielsweise in Synthesen von Frontalin[23] und Undecano-1,5-lacton[24] eingesetzt.
Die Reaktion mit Diboran ergebt Dimethylsulfidboran, das als stabileres Syntheseäquivalent von Diboran dient.[25] In der Corey-Kim-Oxidation wird das eigentliche Oxidationsmittel aus Dimethylsulfid und N-Chlorsuccinimid gewonnen.[26] Mit Methyliodid reagiert Dimethylsulfid zu Trimethylsulfoniumiodid.[27]
Verwendung
In der Industrie wird DMS bei der Raffination von Erdöl sowie in petrochemischen Produktionsprozessen zur Reduktion der unerwünschten Bildung von Koks und Kohlenstoffmonoxid verwendet.[28] Außerdem wird es in einer Reihe von organischen Synthesen genutzt. Ein weiteres Anwendungsgebiet findet sich als Duftstoff für Kosmetika[29] und als Aromakomponente in der Lebensmittelindustrie. So ist es in der EU unter der FL-Nummer 12.006 als Aromastoff zugelassen.[30]
Die Genehmigung von Dimethylsulfid als Grundstoff zur Verwendung als nichtletaler Lockstoff für Trüffelkäfer (Leiodes cinnamomeus) wurde auf Grund der toxikologischen Bewertungen und Bedenken in der EU nicht erteilt.[31]
Sicherheitshinweise
Dimethylsulfid ist eine leichtentzündliche Chemikalie (Flammpunkt: −45 °C im geschlossenen Tiegel; Zündtemperatur: 205 °C) und als gesundheitsschädlich eingestuft. Es ist sehr leicht flüchtig, die Dämpfe sind schwerer als Luft und bilden mit ihr ein explosionsfähiges Gemisch. Die untere Explosionsgrenze liegt bei 2,2, die obere bei 19,7 Volumenprozent DMS. Mit einer Mindestzündenergie von 0,48 mJ sind Dampf-Luft-Gemische extrem zündfähig.[32]
Einzelnachweise
- ↑ Eintrag zu DIMETHYL SULPHIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- ↑ a b c d e f g h i j k l Eintrag zu Dimethylsulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. April 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Dimethylsulfid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-210.
- ↑ Gigiena i Sanitariya. For English translation, see HYSAAV. 32(3), 1967.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ A. Stafisso, O. Marconi, G. Perretti, P. Fantozzi: Determination of dimethyl sulphide in brewery samples by headspace gas chromatography mass spectrometry (HS-GC/MS). In: Italian Journal of Food Science. Band 23, Nr. 1. Chiriotti, Januar 2011, S. 19–27.
- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 61–62, ISBN 978-3-8348-1245-2.
- ↑ T. Talou, A. Gaset, M. Delmas, M. Kulifaj, C. Montant: Dimethyl sulphide: the secret for black truffle hunting by animals? In: Mycological Research. Band 94, Nr. 2, März 1990, S. 277–278, doi:10.1016/S0953-7562(09)80630-8.
- ↑ Marcus C. Stensmyr, Isabella Urru, Ignazio Collu, Malin Celander, Bill S. Hansson, Anna-Maria Angioy: Rotting smell of dead-horse arum florets. In: Nature. Band 420, Nr. 6916, Dezember 2002, S. 625–626, doi:10.1038/420625a.
- ↑ A. Lana et al.: An updated climatology of surface dimethlysulfide[sic!] concentrations and emission fluxes in the global ocean, Global Biogeochemical Cycles 25, 2011, GB1004, doi:10.1029/2010GB003850.
- ↑ Robert J. Charlson, Tom M. L. Wigley: Sulfate Aerosol and Climatic Change. In: Scientific American. Band 270, Nr. 2, Februar 1994, S. 48–57, doi:10.1038/scientificamerican0294-48.
- ↑ E. S. Saltzman, D. L. Savoie, R. G. Zika, J. M. Prospero: Methane sulfonic acid in the marine atmosphere. In: Journal of Geophysical Research: Oceans. Band 88, C15, 20. Dezember 1983, S. 10897–10902, doi:10.1029/JC088iC15p10897.
- ↑ Research Highlight: Plastic smells good to marine birds. Nature 539, 2016, doi:10.1038/539332a.
- ↑ Webb Discovers Methane, Carbon Dioxide in Atmosphere of K2-18 b. In: NASA. Abgerufen am 22. August 2024 (englisch).
- ↑ Webb Probably Didn’t Detect Biosignature Gas on K2-18b. In: Sci.News. 2. Mai 2024, abgerufen am 22. August 2024 (englisch).
- ↑ Shang-Min Tsai, Hamish Innes, Nicholas F. Wogan, Edward W. Schwieterman: Biogenic Sulfur Gases as Biosignatures on Temperate Sub-Neptune Waterworlds. In: The Astrophysical Journal Letters. Band 966, L24. American Astronomical Society, 10. Mai 2024, S. 1–11, doi:10.3847/2041-8213/ad3801.
- ↑ Nikku Madhusudhan, Savvas Constantinou, Måns Holmberg, Subhajit Sarkar, Anjali A. A. Piette, and Julianne I. Moses: New Constraints on DMS and DMDS in the Atmosphere of K2-18 b from JWST MIRI. In: The Astrophysical Journal Letters. Band 983, Nr. 2. American Astronomical Society, 17. April 2025, doi:10.3847/2041-8213/adc1c8.
- ↑ Kathrin-Maria Roy: Thiols and Organic Sulfides. In: Ullmann’s Encyclopedia of Industrial Chemistry. 2000, doi:10.1002/14356007.a26_767 (englisch).
- ↑ Dimethylsulfid. In: Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. 7. Auflage. Band 2. Frankh'schje Verlagshandlung, Stuttgart 1973, S. 859.
- ↑ Gabriel Tojo, Marcos Fernández: Oxidation of alcohols to aldehydes and ketones: a guide to current common practice (= Basic reactions in organic synthesis). Springer, New York, NY 2006, ISBN 978-0-387-23607-0, S. 97–99.
- ↑ Reinhard Brückner: Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 25: Aldehydes. Thieme, 2014, ISBN 978-3-13-178181-9, 25.1.1.1.1 (google.de).
- ↑ James K. Whitesell, Charles M. Buchanan: Synthesis of (-)- and (+)-frontalin. In: The Journal of Organic Chemistry. Band 51, Nr. 26, Dezember 1986, S. 5443–5445, doi:10.1021/jo00376a081.
- ↑ Jue-Liang Hsu, Jim-Min Fang: Stereoselective Synthesis of δ-Lactones from 5-Oxoalkanals via One-Pot Sequential Acetalization, Tishchenko Reaction, and Lactonization by Cooperative Catalysis of Samarium Ion and Mercaptan. In: The Journal of Organic Chemistry. Band 66, Nr. 25, 1. Dezember 2001, ISSN 0022-3263, S. 8573–8584, doi:10.1021/jo016058t (acs.org [abgerufen am 13. September 2025]).
- ↑ Roy M. Adams, John Beres, Alan Dodds, Alfred J. Morabito: Dimethyl sulfide-borane as a borane carrier. In: Inorganic Chemistry. Band 10, Nr. 9, September 1971, S. 2072–2074, doi:10.1021/ic50103a049.
- ↑ Jie Jack Li: Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications. Springer Science & Business Media, 2007, ISBN 978-3-540-30031-1, S. 162 (google.de [abgerufen am 13. September 2025]).
- ↑ Thomas N. Sorrell: Organic Chemistry. University Science Books, 2006, ISBN 978-1-891389-38-2, S. 228 (google.de [abgerufen am 13. September 2025]).
- ↑ Dimethyl Sulfide. In: Chevron Phillips Chemical Company LLC. Abgerufen am 22. August 2024 (englisch).
- ↑ Dimethyl Sulfide. In: PerfumersWorld Ltd. Abgerufen am 22. August 2024 (englisch).
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 13. September 2025.
- ↑ Durchführungsverordnung (EU) 2021/1451 der Kommission vom 3. September 2021 zur Nichtgenehmigung von Dimethylsulfid als Grundstoff gemäß der Verordnung (EG) Nr. 1107/2009 des Europäischen Parlaments und des Rates über das Inverkehrbringen von Pflanzenschutzmitteln. In: Europäische Kommission (Hrsg.): Amtsblatt der Europäischen Union. 3. September 2021 (europa.eu).
- ↑ Hsu-Fang Chen, Chan-Cheng Chen: A quantitative structure activity relationship model for predicting minimum ignition energy of organic substance in J. Loss Prev. Proc. Ind. 67 (2020) 104227, doi:10.1016/j.jlp.2020.104227.

