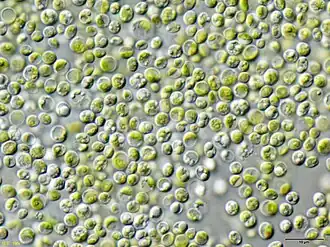
Chlorella vulgaris
| Chlorella vulgaris | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Chlorella vulgaris | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Chlorella vulgaris | ||||||||||||
| Beij. |
Chlorella vulgaris ist eine einzellige Grünalge, die als Chlorophyta zum Phytoplankton gezählt wird und am Beginn zahlreicher Nahrungsketten steht.
Die Einzeller haben einen Durchmesser von ca. 4–10 μm und eine kugelige Form. Die vegetative Vermehrung findet durch Bildung von Autosporen statt. Eine geschlechtliche Fortpflanzung ist nicht bekannt. C. vulgaris kommt in stehenden und Fließgewässern, sowohl in Süß- und Brackwasser vor und ist durch ihre Halophilie zusätzlich an das Leben in Ozeanen angepasst[1]. Die weltweit verbreitete Alge lebt frei schwimmend oder besiedelt feste Oberflächen.
C. vulgaris wird als Modellorganismus in der wissenschaftlichen Forschung seit langer Zeit verwendet. Der Mechanismus der Photosynthese wurde durch diese Alge entschlüsselt.
Entdeckung und Erforschung
Diese Art wurde 1889 von Martinus Willem Beijerinck bei Delft isoliert. Sie ist als Typusart der Gattung Chlorella in offiziellen Stammsammlungen wie der Deutschen Sammlung von Mikroorganismen hinterlegt und wird dort weitergezüchtet.
In den 1950er Jahren begann man, sich mit der Kultivation von Mikroalgen wie C. vulgaris zu beschäftigen. Damals stand die Frage im Fokus, wie man die wachsende Weltbevölkerung zukünftig mit ausreichend Protein versorgen kann. Die getrocknete Biomasse von C. vulgaris enthält ca. 50 Prozent Protein und der Ertrag pro Hektar liegt mit bis zu 120 t/a weit über dem konventioneller Landwirtschaft (z. B. Weizen: ca. 7 t/a/ha).
Erforscht wird zudem die Verwendung von Chlorella vulgaris für Lebenserhaltungssysteme in der Langzeit-Raumfahrt. In abgeschlossenen Systemen, wie zum Beispiel in Raum-, Mond- und Marsstationen, könnte sie zur Wasseraufbereitung, zur Sauerstoff- und zur Nahrungserzeugung genutzt werden.[2]
Wirtschaftliche Bedeutung

Neben ihrer wichtigen ökologischen Funktion als Nahrungsbasis für zahlreiche Organismen, eignet sich C. vulgaris auch als Bestandteil von Futtermitteln für die Fischzucht in Aquakultur.[3]
Da die Mikroalge in großen Mengen kultiviert werden kann, findet sie zudem Einsatz als Nahrungsergänzungsmittel, als Rohstoff für die Kosmetikindustrie und Ausgangsstoff für industrielle Anwendungen (u. a. algenbasierte Kunststoffe).
Zu den kommerziellen Anbaubetrieben, die sich in Europa auf die Zucht von Chlorella spezialisiert haben, zählen u. a. Nutriphys (Ghislenghien, Belgien)[4], Synoxis Algae (Le Cellier, Frankreich), sowie Algomed in Sachsen-Anhalt[5].
Die Mikroalge eignet sich, durch Inhaltsstoffe wie Proteine, Lipide, Vitamine und Mineralstoffe, aus ernährungswissenschaftlicher Sicht zur Anreicherung von Lebensmitteln geeignet. In der Lebensmittelindustrie findet sie daher bereits als Zusatz für Smoothies, Snacks und werden zudem pulverisiert oder in Tablettenform als Superfood oder Nahrungsergänzungsmittel vermarktet. Zudem enthält Chlorella vulgaris Antioxidans und hat einen stärkenden Einfluss auf das menschliche Immunsystem.[6]
Darüber hinaus ist diese Alge eine Quelle für bestimmte mehrfach ungesättigte Fettsäuren (z. B. alpha-Linolensäure) und Carotinoide (z. B. Lutein).
Neben Anwendungsbereichen als Nahrungsergänzungs- und Futtermittel oder Zusatzstoff, wäre auch die Nutzung als Ausgangsstoff für Biodiesel möglich.[1]
Negative Veränderungen durch menschliche Verschmutzung
Durch die steigende Konzentration von Nanoplastik (auf Polystyrolbasis) in Gewässern, sinkt die Wachstumsrate der Mikroalge messbar, um mehr als 40 Prozent. Zugleich weisen Algen, bei einer erhöhten Nanoplastikbelastung einen geringeren Proteinanteil, eine schwächere Pigmentierung und eine geringere enzymatische Aktivität auf. Die Auswirkungen auf aquatische Ökosysteme und die damit in Verbindung stehenden Nahrungsketten, sind aus heutiger Sicht nicht absehbar, könnten jedoch, insbesondere in Kombination mit anderen Schadstoffen, gravierend sein.[7]
Systematik
Neben C. lobophora und C. sorokiniana gehört sie zur Gattung Chlorella innerhalb der Klasse der Trebouxiophyceae.[8] C. vulgaris wurde früher zusammen mit anderen, ähnlich aussehenden Arten unter dem Namen C. pyrenoidosa geführt. 1992 konnte jedoch gezeigt werden, dass es eine Art „Chlorella pyrenoidosa“ nicht gibt.[9]
Symbiosen
C. vulgaris kommt als mutualistischer Symbiont in den Geweben der Süßwasser-Plattwürmer Dalyellia viridis und Typhloplana viridata (beide Ordnung Rhabdocoela) vor.[10]
C. vulgaris dient (ebenso wie C. sorokiniana) dem parasitär lebenden Bakterium Vampirovibrio chlorellavorus (aus dem Stamm der Melainabacteria) als Wirt.[11][12]
Literatur
- Jörg Ullmann: Der Unterschied zwischen Chlorella vulgaris und Chlorella pyrenoidosa. Zur Stellung der Taxa „Chlorella pyrenoidosa“ Chick und „Chlorella vulgaris“ Beijerinck innerhalb der Chlorophyta (Grünalgen). 2006
- Henrik Heinrichs: Chlorella Vulgaris Vs. Chlorella Pyrenoidosa. Das Algen-Lexikon: Chlorella, Spirulina & Astaxanthin, Chlorella Wissen, Stand: 5. Juni 2018
- Chiao-An Wang, Helen Onyeaka, Taghi Miri, Fakhteh Soltani: Chlorella vulgaris as a food substitute: Applications and benefits in the food industry. In: Jpurnal of Food Science, Band 89, Nr. 12, Dezember 2024, S. 8231–8247; doi:10.1111/1750-3841.17529, Epub 18. November 2024 (englisch). Dazu:
- This Superfood You’ve Never Heard of Could Change the Way We Eat. Auf: SciTechDaily vom 17. März 2025. Quelle: University of Birmingham.
Weblinks
Einzelnachweise
- ↑ a b R. Rautenberger, A. Détain, K. Skjånes, P.S.C. Schulze, V. Kiron & D. Morales-Sánchez: Growth strategies of Chlorella vulgaris in seawater for a high production of biomass and lipids suitable for biodiesel. Algal Research, Vol. 77, January 2024, 103360. doi:10.1016/j.algal.2023.103360
- ↑ Gisela Detrell: Chlorella vulgaris photobioreactor for oxygen and food production on a moon base - potential and challenges, 2021, Universitätsbibliothek der Universität Stuttgart, in: Frontiers in astronomy and space sciences 8 (2021), article 700579 online. Abgerufen am 16. November 2023
- ↑ Najah M. Albaqami: Chlorella vulgaris as unconventional protein source in fish feed: A review. Aquaculture, Vol. 594, 15 January 2025, 741404. doi:10.1016/j.aquaculture.2024.741404
- ↑ Fist Importer of Chlorella in Europe. nutriphys.com, abgerufen am 8. April 2025
- ↑ Algomed. Über uns. algomed.de, abgerufen am 8. April 2025
- ↑ Chiao‐An Wang, Helen Onyeaka, Taghi Miri & Fakhteh Soltani: Chlorella vulgaris as a food substitute: Applications and benefits in the food industry. J Food Sci. 2024 Nov 18;89(12):8231–8247. doi:10.1111/1750-3841.17529 PMID 39556490
- ↑ Pritam Sarkar, K.A. Martin Xavier, Satya Prakash Shukla & Govindarajan Rathi Bhuvaneswari: Nanoplastic exposure inhibits growth, photosynthetic pigment synthesis and oxidative enzymes in microalgae: A new threat to primary producers in aquatic environment. Journal of Hazardous Materials Advances, Vol. 17, Feb. 2025, 100613. doi:10.1016/j.hazadv.2025.100613
- ↑ L. Krienitz, E.H. Hegewald, D. Hepperle, V.A.R. Huss, T. Rohr, M. Wolf: Phylogenetic relationship of Chlorella and Parachlorella gen. nov. (Chlorophyta, Trebouxiophyceae). In: Phycologia, 43, 2004, S. 529–542, doi:10.2216/i0031-8884-43-5-529.1.
- ↑ E. Kessler, V.A.R. Huss Comparative physiology and Biochemistry and taxonomic assignment of the Chlorella (Chlorophyceae) strains of the culture collection of the University of Texas at Austin. In: Journal of Phycology, 28, 1992, S. 550–553, doi:10.1111/j.0022-3646.1992.00550.x.
- ↑ J. O. Young: Keys to the freshwater microturbellarians of Britain and Ireland. Freshwater Biological Association, Ambleside 2001, S. 92 (englisch).
- ↑ Rochelle M. Soo, Ben J. Woodcroft, Donovan H. Parks, Gene W. Tyson, Philip Hugenholtz: Back from the dead; the curious tale of the predatory cyanobacterium Vampirovibrio chlorellavorus. In: PeerJ, Band 3, 21. Mai 2015, e968, doi:10.7717/peerj.968, PMID 26038723, PMC 4451040 (freier Volltext)
- ↑ Blake T. Hovde, Seth A. Steichen, Shawn R. Starkenburg, Judith K. Brown: Vampirovibrio chlorellavorus draft genome sequence, annotation, and preliminary characterization of pathogenicity determinants. In: Phycological Research, Band 68, Nr. 1, S. 23–29. 17. Juli 2019. doi:10.1111/pre.12392