Candidatus Nitrohelix vancouverensis
| Candidatus Nitrohelix vancouverensis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Candidatus Nitrohelix vancouverensis | ||||||||||||
| Maire et al. 2024 |
Candidatus Nitrohelix vancouverensis ist eine Bakterienart. Sie konnte noch nicht einzeln kultiviert werden, zur Beschreibung wurde es zusammen mit einem Bakterienstamm, der mit dem Bakterium Stappia stellulata nah verwandt ist, kultiviert. Von daher wird die Art als Candidatus eingestuft. Sie zählt zu den im Meer vorkommenden Nitrit oxidierenden Bakterien (NOB). Solche Bakterien bilden aus Nitrit das Nitrat und gewinnen daraus Energie. Nitrat stellt wiederum für andere Lebewesen eine Quelle für Stickstoff dar. Somit sind diese, auch als Nitrifizierer bezeichneten Bakterien, wichtig für den Stickstoffkreislauf der Erde.[1]
Merkmale
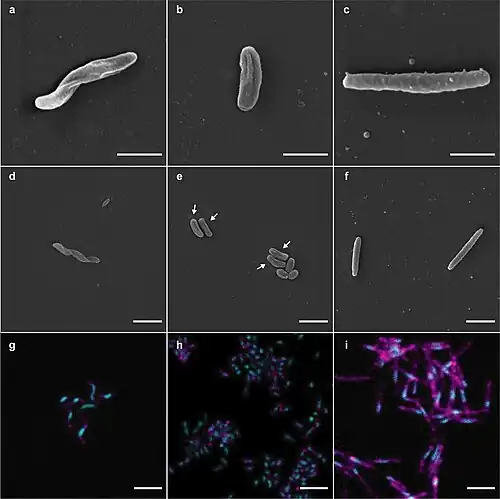
Die Zellen sind helikal geformte Stäbchen mit 1–3 Windungen. Der Gram-Test fällt negativ aus. Sie erreichen eine Länge von etwa 3 µm. Die spiralige Zellform ähnelt der Form von Zellen der Nitrospira-Arten. Die Kultivierung erfolgte in flüssigem marinem Medium mit einer Nitritkonzentration von 0,5 mM bei 28 °C. Es konnte noch keine Kultur auf festem Medium erzeugt werden. Genomische Analysen zeigten eine Auxotrophie für Vitamin B12, was für das erfolgreiche Wachstum und den Nährstoffbedarf relevant ist.[1]
Stoffwechsel
Candidatus Nitrohelix vancouverensis ist ein chemolithoautotrophes Bakterium, das Nitrit zu Nitrat oxidiert und somit an der Nitrifikation beteiligt ist. Chemolithoautotroph bedeutet, dass keine organischen Stoffe von dem Bakterium benötigt werden. Gefundene Schlüsselgene weisen darauf hin, dass es Kohlendioxid (CO2) durch den reduktiven Citratzyklus fixiert. Es sind auch alle für den oxidativen Citratzyklus notwendigen Gene vorhanden. Es kann des Weiteren Glykogen als Energiespeicherstoff bilden. Dieser kann über die Glykolyse und den Citratzyklus abgebaut werden.[1] Das Genom umfasst ein einzelnes Chromosomen mit einer Größe von rund 3.309.797 bp. Der G+C-Gehalt der DNA beträgt etwa 51 mol%.[1]
Nitrifizierung und Ökologie
Nitrohelix vancouverensis bildet durch die Nitrifikation aus Nitrit das Nitrat um Energie zu gewinnen. Nitrit fungiert als Elektronendonor (also als Elektronenspender) für die Reduktion von NAD über einen Elektronenfluss sowie für die Erzeugung von ATP durch oxidative Phosphorylierung.[2] Es gibt auch Bakterien, die Ammoniak zu Nitrit oxidieren. Die Nitrifikation ist also ein zweistufiger Prozess bei dem Ammoniak über Nitrit in Nitrat umgewandelt wird. Bisher sind relativ wenige Mikrobenarten bekannt, die beide Schritte durchführen können. Hierzu zählt z. B. Nitrospira.[3] Die Nitrifikation spielt eine Schlüsselrolle bei der Umwandlung von Stickstoffdünger in landwirtschaftlichen Systemen und ist auch eine Komponente der Stickstoffentfernung in der Abwasserbehandlung. Die Produktion von löslichem anorganischem Stickstoff (also Nitrit und Nitrat) durch Nitrifikation kann auch zu einer Verunreinigung und Eutrophierung terrestrischer und aquatischer Ökosysteme führen. Des Weiteren bilden Nitrifizierer auch die gasförmigen Produkte Stickstoffoxid (NO) und Distickstoffmonoxid (Lachgas, N2O), die das stratosphärische Ozon zerstören und erheblich zur globalen Erwärmung beitragen. Nitrit-oxidierende Bakterien (NOB) sind am Prozess der Nitrifikation beteiligt, indem sie Nitrit (NO2), das Endprodukt der Ammoniakoxidation, in Nitrat (NO3) nach der folgenden Reaktion umwandeln:
NO2- + H2O -> NO3- 2H+ + 2e-
Es wurden bei Nitrohelix Gene nachgewiesen, die für die verschiedenen Untereinheiten der nitritoxidierenden Enzymkomplexe (NXR) verantwortlich sind. Diese Enzyme ermöglichen die effiziente Umwandlung von Nitrit in Nitrat. Die Art kann unter sehr niedrigen Nitritkonzentrationen effektiv wachsen – was durch einen niedrigen Km(app)-Wert von 8,7 ± 2,5 µM NO2- belegt wird. Er weist auf eine hohe Affinität für Nitrit hin, also dass die Art Nitrit sehr effizient binden und verwerten kann. Nitrohelix vancouverensis ist tatsächlich eines der leistungsfähigsten bekannten marinen NOB. Der Begriff Km(app) (apparent half-saturation constant, scheinbare Halbsättigungskonstante) beschreibt die Substratkonzentration, bei der die enzymatische Reaktion oder der Wachstumsprozess mit der Hälfte der maximalen Geschwindigkeit abläuft. Ein niedriger Km(app)-Wert von 8,7 µM bedeutet, dass das Enzymsystem (in diesem Fall das Nitritoxidationssystem des Organismus) bereits bei sehr geringen Nitritkonzentrationen stark arbeitet – also eine hohe Affinität zum Substrat Nitrit besitzt. Dies ist ökologisch bedeutsam, weil der Organismus auch in Umgebungen mit sehr niedrigen Nitritkonzentrationen effizient wachsen kann.[1] Zum Vergleich: Auch “Candidatus Nitrospira kreftii” hat einen relativ geringen Km(app)-Wert von 12.5 ± 4.0 µM, was ebenfalls als optimal für oligotrophe Umgebungen angesehen wird.[4] Auch die Art Nitrospina gracilis hat einen niedrigen Km-Wert von etwa 20,1 ± 2,1 µM.[1] Die Arten Nitrobacter hamburgensis X14 mit 544 ± 55 und Nitrobacter winogradskyi mit 309 ± 92 zeigen dem hingegen hohe Werte.[5]
Verfügbarer Stickstoff ist in vielen Ökosystemen der wachstumslimitierende Faktor. Dennoch kann in marinen Lebensräumen auch ein Überschuss an Stickstoff aufgrund anthropogener Verschmutzung oder Düngung dramatische Auswirkungen haben, beispielsweise Küsteneutrophierung und die Bildung hypoxischer Todeszonen. Der Großteil des fixierten Stickstoffs in marinen Systemen besteht aus Nitrat (NO3−). Obwohl die Nitritoxidation durch chemolithoautotrophe Mikroorganismen als der bedeutendste biologische Weg zur Nitratproduktion gilt, ist über die zugrunde liegende Mikrobiologie der Ozeane überraschend wenig bekannt.[1] Die bekannte Diversität mariner Nitrit oxidierender Bakterien (NOB) besteht aus Mitgliedern des Phylums Nitrospinota (auch als Nitrospinae bezeichnet) und Vertretern der Gattungen Nitrospira, Nitrococcus, Nitrobacter und "Ca. Nitrotoga".[3] Unter diesen sind die Nitrospinota die am häufigsten vorkommenden NOB in der Mehrheit der bislang untersuchten Meeresökosystemen (Stand 2022). Die verschiedenen Arten der Nitrospinota kommen in zahlreichen Habitaten vor, darunter in der freien Wassersäule, Sedimenten, Tiefseegräben und auch in sauerstoffarmen Gebieten. Letzteres ist auffällig, da die Nitritoxidation ein aerober Prozess ist, sie erfordert also Sauerstoff. Hier wurden zwei Dinge gezeigt: Ein hohes Vorkommen von Nitrit-Oxidoreduktase (NXR): Dieses Enzym, das für die Umwandlung von Nitrit in Nitrat entscheidend ist, wurde in metaproteomischen Untersuchungen von OMZ in großen Mengen nachgewiesen. Des Weiteren werden hohe In-situ-Nitrit-Oxidationsraten beobachtet: Trotz der sauerstoffarmen Umgebung sind die tatsächlichen Raten, mit denen Nitrit im Feld oxidiert wird, hoch. Dies ist ein interessantes Paradoxon, da man unter sauerstoffarmen Bedingungen eine geringere Nitritoxidationsaktivität erwarten würde. Die Beobachtung deutet darauf hin, dass sich diese mikrobiellen Gemeinschaften in irgendeiner Weise angepasst haben, um eine hohe Nitritoxidation aufrechtzuerhalten, auch wenn der Sauerstoff knapp ist, oder dass es innerhalb der OMZ Mikroumgebungen gibt, in denen der Sauerstoff für den Prozess ausreichend ist.[1]
Neben ihrer Bedeutung im Stickstoffkreislauf wird vermutet, dass die Nitrospinota auch eine wichtige Rolle bei der Kohlenstofffixierung im Ozean spielen, da sie in manchen Umgebungen bis zu 15–45 % des fixierten anorganischen Kohlenstoffs beitragen. Der Beitrag der Nitrospinota zur CO2-Fixierung wird jedoch weiterhin diskutiert, was teilweise auf einen Mangel an kultivierten repräsentativen Organismen zurückzuführen ist.
Bei „Ca. Nitrohelix vancouverensis“ zeigt der niedrige Km(app)-Wert von 8,7 ± 2,5 µM NO2-, dass es bereits bei sehr geringen Nitritkonzentrationen effizient arbeitet. Diese hohe Affinität ist besonders ökologisch bedeutsam, da in vielen marinen, oligotrophen Umgebungen Nitrit oft in extrem niedrigen Konzentrationen vorliegt. Somit ist diese Art in der Lage, auch unter limitierenden Bedingungen zur Nitrifizierng beizutragen und Nitrat zu produzieren. Es kann so die Verfügbarkeit von Nitrat für andere Organismen, wie z. B. für Arten des Phytoplanktons, verbessern.[1]
Systematik
Die Candidatus-Art Nitrohelix vancouverensis gehört zur Familie Nitrospinaceae innerhalb des Phylums Nitrospinae.[6] Im April 2025 zählten noch zwei andere Gattungen zu der Familie Nitrospinaceae: Nitrospina und Candidatus Nitronauta.
Der gewählte Name „Nitrohelix“ verweist auf die Nitratbildung und auf die spiralige (helixförmige) Zellmorphologie, während der Artname „N. vancouverensis“ den Isolationsort Vancouver in Kanada betont.[1]
Einzelnachweise
- ↑ a b c d e f g h i j Anna J Mueller, Man-Young Jung, Cameron R Strachan, Craig W Herbold, Rasmus H Kirkegaard, Michael Wagner, Holger Daims: Genomic and kinetic analysis of novel Nitrospinae enriched by cell sorting. In: The ISME Journal. Band 15, Nr. 3, 1. März 2021, ISSN 1751-7362, S. 732–745, doi:10.1038/s41396-020-00809-6, PMID 33067588, PMC 8026999 (freier Volltext) – (oup.com [abgerufen am 30. März 2025]).
- ↑ Shawn R. Starkenburg, Frank W. Larimer, Lisa Y. Stein, Martin G. Klotz, Patrick S. G. Chain, Luis A. Sayavedra-Soto, Amisha T. Poret-Peterson, Mira E. Gentry, Daniel J. Arp, Bess Ward, Peter J. Bottomley: Complete Genome Sequence of Nitrobacter hamburgensis X14 and Comparative Genomic Analysis of Species within the Genus Nitrobacter. In: Applied and Environmental Microbiology. Band 74, Nr. 9, Mai 2008, ISSN 0099-2240, S. 2852–2863, doi:10.1128/AEM.02311-07, PMID 18326675, PMC 2394895 (freier Volltext) – (asm.org [abgerufen am 31. März 2025]).
- ↑ a b Holger Daims, Sebastian Lücker, Michael Wagner: A New Perspective on Microbes Formerly Known as Nitrite-Oxidizing Bacteria. In: Trends in Microbiology. Band 24, Nr. 9, September 2016, ISSN 0966-842X, S. 699–712, doi:10.1016/j.tim.2016.05.004.
- ↑ Dimitra Sakoula, Hanna Koch, Jeroen Frank, Mike S M Jetten, Maartje A H J van Kessel, Sebastian Lücker: Enrichment and physiological characterization of a novel comammox Nitrospira indicates ammonium inhibition of complete nitrification. In: The ISME Journal. Band 15, Nr. 4, 1. April 2021, ISSN 1751-7362, S. 1010–1024, doi:10.1038/s41396-020-00827-4, PMID 33188298, PMC 8115096 (freier Volltext) – (oup.com [abgerufen am 31. März 2025]).
- ↑ Zicheng Su, Tao Liu, Jianhua Guo, Min Zheng: Nitrite Oxidation in Wastewater Treatment: Microbial Adaptation and Suppression Challenges. In: Environmental Science & Technology. Band 57, Nr. 34, 29. August 2023, ISSN 0013-936X, S. 12557–12570, doi:10.1021/acs.est.3c00636, PMID 37589598, PMC 10470456 (freier Volltext) – (acs.org [abgerufen am 31. März 2025]).
- ↑ LPSN