Candidatus Nitrotoga
| Candidatus Nitrotoga | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
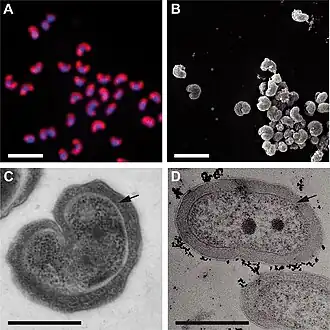
Morphologie von "Ca. Nitrotoga fabula". (A) Reinkultur von "Ca. Nitrotoga fabula„, visualisiert durch FISH mit der “Ca. Nitrotoga"-spezifischen Sonde Ntoga122 (rot) und durch DAPI-Färbung (blau). Balken, 2 µm. (B) Rasterelektronenmikroskopische Aufnahme nach chemischer Fixierung (Balken, 2 µm). (C und D) Transmissionselektronenmikroskopische Aufnahmen (nach Kryokonservierung [C] und nach chemischer Fixierung [D]; Balken, 0,5 µm). Schwarze Pfeile zeigen den periplasmatischen Raum an. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Candidatus Nitrotoga | ||||||||||||
| Alawi et al. 2007 |
Candidatus Nitrotoga ist eine Gattung von Bakterien. Die Arten konnten noch nicht einzeln kultiviert werden, deswegen wird es als Candidatus geführt. Sie zählen zu den Nitrit oxidierenden Bakterien (NOB) der Nitrifizierer. Solche Bakterien bilden aus Nitrit das Nitrat und gewinnen daraus Energie. Nitrat stellt wiederum für andere Lebewesen eine Quelle für Stickstoff dar. Somit sind diese, auch als Nitrifizierer bezeichneten Bakterien, wichtig für den Stickstoffkreislauf der Erde.[1] Eine Besonderheit der Art Ca. Nitrotoga arctica ist das Wachstum bei relativ niedrigen Temperaturen von 4 °C und die Fähigkeit auch niedrige Werte von Nitrit in der Umwelt gut zu nutzen.[2] Die Art Ca. Nitrotoga fabula ist dem hingegen mesophil, d. h. es bevorzugt gemäßigte Temperaturen.[3]
Merkmale
Die Arten "Ca. Nitroga arcitaca" und "Ca. N. fabula" sind nicht beweglich, Flagellen sind nicht vorhanden. Die Zellen von Nitrotoga arcitaca sind kokkenförmig bis kurze stäbchenförmige Zellen mit einer Größe von 0,4–0,7 1,0 mm. Der Gram-Test verläuft negativ, das heißt die Bakterien besitzen zwei äußere Membranen, dazwischen befindet sich ein Periplasmatischer Raum. Die Zellen von “Ca. Nitroga arcitaca” zeigen eine charakteristische Morphologie: Zytoplasma und äußere Membran stehen an der Längsachse nicht in engem Kontakt wie bei den meisten anderen gramnegativen Bakterien und sie erscheinen mit einem breiten, „ballonartigen“ Periplasma und einer "Eiweisartigen"-artigen Querschnittsstruktur.[2] Ein ungewöhnlich breiter periplasmatischer Raum wurde bereits für Mitglieder der Gattung Nitrospira beschrieben,[4] aber bei Nitrotoga arcitaca ist es noch ausgeprägter.[2] Die Zellen von "Ca. N. fabula" haben eine eigentümliche bohnenförmige Morphologie, und der periplasmatische Raum ist nicht so stark vergrößert, wie bei "Ca. Nitrotoga arcitaca". Die Zellen sind mit einer Länge von 1 µm und einer Breite von etwa 0,5 µm ebenfalls recht klein. "Ca. N. fabula" bildet bei hoher Zelldichte ebenfalls lose Flocken.[3]
Stoffwechsel und Wachstum
Die Arten sind aerob, sie benötigen Sauerstoff für das Wachstum. Sie führen eine chemolithotrophen Stoffwechsel mit der Oxidation von Nitrit zu Nitrat durch. Sie zählen zu den Nitrifizier. Kohlendioxid (CO2) wird als die einzige Kohlenstoffquelle verwendet.
"Ca. Nitrotoga fabula" trägt auch Gene, die für vollständige Wege der Wasserstoff- und Sulfitoxidation kodieren, was darauf hindeutet, dass es in die Lage versetzt, Nitritmangel zu überleben und neue ökologische Nischen zu besiedeln.
Nitrifikation
Nitrotoga arctica zeigt eine hohe Affinität für Nitrit, was durch einen niedrigen Km(app)-Wert (Km(app) von etwa 8,7 ± 2,5 µM NO₂⁻) belegt wird.[2] Der Begriff Km(app) (apparent half-saturation constant, scheinbare Halbsättigungskonstante) beschreibt die Substratkonzentration, bei der die enzymatische Reaktion oder der Wachstumsprozess mit der Hälfte der maximalen Geschwindigkeit abläuft. Ein niedriger Km(app)-Wert von 8,7 µM bedeutet, dass das Enzymsystem (in diesem Fall das Nitritoxidationssystem des Organismus) bereits bei sehr geringen Nitritkonzentrationen stark arbeitet – also eine hohe Affinität zum Substrat Nitrit besitzt.
Bei dem noch nicht näher bestimmten Stamm “Ca. Nitrotoga sp. AM1” liegt der Km(app)-Wert bei 25 µM.[3] "Ca. Nitrotoga fabula" zeigt einen Km-Wert von 89.3 ± 3.9 µM.[3] Die etwas geringere Affinität für Nitrit von "Ca. Nitrotoga fabula" könnte die Anpassung an unterschiedliche Lebensräume widerspiegeln. In Anreicherungskulturen können die begleitenden Organismen jedoch auch Sauerstoff veratmen oder Nitrit verbrauchen (z. B. für die Denitrifikation) und damit die Messungen beeinflussen. In beiden Fällen kann die Affinität der NOB in Anreicherungskulturen überschätzt werden. Der Vergleich von Ergebnissen, die durch Analysen eines Isolats und von Anreicherungskulturen erzielt wurden, ist daher mit Vorsicht zu interpretieren. Im Vergleich zu anderen NOB ist die Affinität für Nitrit von "Ca. Nitrotoga" mäßig. Insbesondere einige Arten vom Nitrospira mit einer deutlich höheren Affinität können "Ca. Nitrotoga" in oligotrophen Lebensräumen und in kontinuierlich betriebenen Kläranlagen (die Chemostaten ähneln), in denen die Nitritkonzentration in der Umgebung niedrig ist, übertreffen. So liegt z. B. der Km(app)-Wert von Nitrospira defluvii bei 9 µM.[3]
Die hohe Affinität von "Ca. N. artica" ist ökologisch bedeutsam, da in durch Permafrost beeinflussten, oligotrophen Böden oft nur sehr geringe Nitritkonzentrationen vorhanden sind. Bei Nitrotoga befindet sich das Nitrit-Oxidase-System (“nitrite-oxidizing system”), also der Enzymkomplex für die Bildung von Nitrat aus Nitrit, im periplasmatischen Raum zwischen den beiden Membranen. Dies ist auch bei "Candidatus Nitromaritima", Nitrospira und Nitrospina der Fall. In Nitrobacter (dem wichtigsten NOB in Süßwassersystemen), Nitrococcus und Nitrolancea heißt das Schlüsselenzym jedoch "Nitrit-Oxidoreduktase" (NXR) und befindet sich in intrazytoplasmatischen und zytoplasmatischen Membranen.[5]
Die wichtigsten Stoffwechselwege von "Ca. Nitrotoga fabula" wurden aus dem Genom rekonstruiert. "Ca. Nitrotoga fabula" besitzt eine neue Art von periplasmatischer Nitrit-Oxidoreduktase, die zu einer Linie von größtenteils uncharakterisierten Proteinen gehört (Stand 2018). Dies könnte auf unerkannte NOB und das mögliche Vorhandensein von Nitrit-oxidierenden Archaeen hindeuten. Für die Kohlenstofffixierung verwendet "Ca. Nitrotoga fabula" den Calvin-Zyklus. Das pH Optimum liegt bei dieser Art zwischen 7,1 und 7,6.
Ökologie
Die Nitrifikation ist ein zentraler Prozess im globalen Stickstoffkreislauf. Nitritoxidierende Bakterien (NOB) tragen hier zur Produktion von Nitrat bei, letzteres ist wiederum als Nährstoff für andere Organismen (z. B. Phytoplankton) wichtig. Es wird durch die Bildung von Nitrat aus Nitrit Energie gewonnen. Nitrit fungiert als Elektronendonor (also als Elektronenspender) für die Reduktion von NAD über einen Elektronenfluss sowie für die Erzeugung von ATP durch oxidative Phosphorylierung.[6]
Die chemische Gleichung für die Umwandlung von Nitrit zu Nitrat lautet folgendermaßen:
NO2- + H2O -> NO3- 2H+ + 2e-
Die Nitrifikation spielt eine Schlüsselrolle bei der Umwandlung von Stickstoffdünger in landwirtschaftlichen Systemen und ist auch eine Komponente der Stickstoffentfernung in der Abwasserbehandlung. Die Produktion von löslichem anorganischem Stickstoff (wie Nitrit und Nitrat) durch Nitrifikation kann aber auch zu einer Verunreinigung und Eutrophierung terrestrischer und aquatischer Ökosysteme führen. Des Weiteren bilden Nitrifizierer auch die gasförmigen Produkte Stickstoffoxid (NO) und Distickstoffmonoxid (Lachgas, N2O), die das stratosphärische Ozon zerstören und erheblich zur globalen Erwärmung beitragen.[2]
Die bekannte Vielfalt der marinen nitritoxidierenden Bakterien (NOB) besteht aus Mitgliedern des Stammes Nitrospinae und Vertretern der Gattungen Nitrospira, Nitrococcus, Nitrobacter und Nitrotoga. Unter diesen sind die Nitrospinota die am häufigsten vorkommenden NOB in den meisten bisher untersuchten Meeresumgebungen. Man hat festgestellt, dass sie in einer Vielzahl von Lebensräumen vorkommen, darunter in der freien Wassersäule, Sauerstoffminimumzonen, Sedimente und Tiefseegräben.[1]
Die Art Ca. Nitrotoga arctica wurde in Böden der Lena-Delta-Region auf Samoylov Island in der sibirischen Arktis gefunden.[2] Traditionell wurden NOB in relativ warmen, mesophilen Habitaten untersucht, doch bislang war wenig über NOB bekannt, die an niedrigen Temperaturen aktiv sind – wie sie beispielsweise in permafrostbeeinflussten Böden der sibirischen Arktis vorkommen. Die Art "Candidatus Nitrotoga arctica" ist somit wichtig für die Erforschung der Kälteanpassung von nitrifizierenden Bakterien.
Klonierte Sequenzen mit hohen Sequenzähnlichkeiten wurden zuvor aus mesophilen Habitaten, also mit gemäßigten Temperaturen, wie Belebtschlamm gemeldet. Die Art "Candidatus Nitrotoga fabula" wächst am besten bei Temperaturen zwischen 24 und 28 °C und zeigt nur noch geringe Aktivität bei < 20 °C. Sie wurde aus aktivem Schlamm eines kommunalen Klärwerks gewonnen.[3]
Bei einer Untersuchung von Belebtschlammproben aus 20 großen Kläranlagen wurden Nitrotoga-ähnliche Bakterien in 11 Proben nachgewiesen und erreichten in sieben Schlämmen durch FISH nachweisbare Mengen. In den meisten dieser Kläranlagen koexistierten sie mit Nitrospira, während sie in zwei Systemen die einzigen nachweisbaren NOB darstellten. Quantitative FISH ergab, dass "Ca. Nitrotoga" in einer dieser Anlagen fast 2 % der gesamten Bakteriengemeinschaft ausmachte, eine Zahl, die mit der Häufigkeit von Nitrospira in anderen Kläranlagen vergleichbar ist. Räumliche Statistiken zeigten, dass Nitrotoga mit Ammoniak-oxidierenden Bakterien koaggregierte, was für eine funktionelle Rolle bei der Nitrit-Oxidation spricht. Diese Aktivität wurde durch FISH in Kombination mit Mikroradiographie bestätigt, die eine nitritabhängige autotrophe Kohlenstofffixierung durch "Ca. Nitrotoga" in situ ergab. Es sieht so aus, dass niedrige Temperaturen ein Hauptfaktor sind, der hohe Nitrotoga-Vorkommen begünstigt, obwohl diese NOB bei Inkubationsexperimenten in einem unerwarteten Temperaturbereich und auch bei unterschiedlichen Nitritkonzentrationen in der Umgebung aktiv blieben. Arten von "Ca. Nitrotoga" können also funktionell wichtige Nitritoxidierer in Kläranlagen sein und sogar die einzigen bekannten NOB in bestimmten technischen Systemen darstellen.[7]
Systematik
Die Gattung Candidatus Nitrotoga wurde 2007 eingeführt, "Candidatus Nitrotoga arctica" war die erste beschriebene Art, ist also die Typusart der Gattung.[8] Die Sequenzanalyse der 16S rRNA-Gene ordnete die Organismen dem Betaproteobakterien zu, mit Gallionella ferruginea als nächstem verwandten taxonomisch beschriebenen Organismus. Bis März 2025 wurde die Gattung noch keiner Familie und Ordnung zugeordnet.
Es sind 2 Arten bekannt (Stand 2. April 2025):[9]
- "Candidatus Nitrotoga arctica" Alawi et al. 2007
- "Candidatus Nitrotoga fabula" Kitzinger et al. 2018
Einzelnachweise
- ↑ a b Anna J Mueller, Man-Young Jung, Cameron R Strachan, Craig W Herbold, Rasmus H Kirkegaard, Michael Wagner, Holger Daims: Genomic and kinetic analysis of novel Nitrospinae enriched by cell sorting. In: The ISME Journal. Band 15, Nr. 3, 1. März 2021, ISSN 1751-7362, S. 732–745, doi:10.1038/s41396-020-00809-6, PMID 33067588, PMC 8026999 (freier Volltext) – (oup.com [abgerufen am 30. März 2025]).
- ↑ a b c d e f Mashal Alawi, André Lipski, Tina Sanders, Eva-Maria-Pfeiffer, Eva Spieck: Cultivation of a novel cold-adapted nitrite oxidizing betaproteobacterium from the Siberian Arctic. In: The ISME Journal. Band 1, Nr. 3, 1. Juli 2007, ISSN 1751-7362, S. 256–264, doi:10.1038/ismej.2007.34 (oup.com [abgerufen am 2. April 2025]).
- ↑ a b c d e f Katharina Kitzinger, Hanna Koch, Sebastian Lücker, Christopher J. Sedlacek, Craig Herbold, Jasmin Schwarz, Anne Daebeler, Anna J. Mueller, Michael Lukumbuzya, Stefano Romano, Nikolaus Leisch, Søren Michael Karst, Rasmus Kirkegaard, Mads Albertsen, Per Halkjær Nielsen, Michael Wagner, Holger Daims: Characterization of the First“ Candidatus Nitrotoga” Isolate Reveals Metabolic Versatility and Separate Evolution of Widespread Nitrite-Oxidizing Bacteria. In: mBio. Band 9, Nr. 4, 5. September 2018, ISSN 2161-2129, doi:10.1128/mBio.01186-18, PMID 29991589, PMC 6050957 (freier Volltext) – (asm.org [abgerufen am 2. April 2025]).
- ↑ Stanley W. Watson, Eberhard Bock, Frederica W. Valois, John B. Waterbury, Ursula Schlosser: Nitrospira marina gen. nov. sp. nov.: a chemolithotrophic nitrite-oxidizing bacterium. In: Archives of Microbiology. Band 144, Nr. 1, Februar 1986, ISSN 0302-8933, S. 1–7, doi:10.1007/BF00454947 (springer.com [abgerufen am 2. April 2025]).
- ↑ Gülsüm Atasoy, Esra Şentürk, Pınar Şanlıbaba: Cultivation, Growth Physiology, and Chemotaxonomy of Nitrite-Oxidizing Bacteria. In: Anammox Technology in Industrial Wastewater Treatment. Springer Nature Singapore, Singapore 2023, ISBN 978-981-9934-58-4, S. 73–90, doi:10.1007/978-981-99-3459-1_5 (springer.com [abgerufen am 3. April 2025]).
- ↑ Shawn R. Starkenburg, Frank W. Larimer, Lisa Y. Stein, Martin G. Klotz, Patrick S. G. Chain, Luis A. Sayavedra-Soto, Amisha T. Poret-Peterson, Mira E. Gentry, Daniel J. Arp, Bess Ward, Peter J. Bottomley: Complete Genome Sequence of Nitrobacter hamburgensis X14 and Comparative Genomic Analysis of Species within the Genus Nitrobacter. In: Applied and Environmental Microbiology. Band 74, Nr. 9, Mai 2008, ISSN 0099-2240, S. 2852–2863, doi:10.1128/AEM.02311-07, PMID 18326675, PMC 2394895 (freier Volltext) – (asm.org [abgerufen am 31. März 2025]).
- ↑ Sebastian Lücker, Jasmin Schwarz, Christiane Gruber-Dorninger, Eva Spieck, Michael Wagner, Holger Daims: Nitrotoga -like bacteria are previously unrecognized key nitrite oxidizers in full-scale wastewater treatment plants. In: The ISME Journal. Band 9, Nr. 3, 1. März 2015, ISSN 1751-7362, S. 708–720, doi:10.1038/ismej.2014.158, PMID 25180967, PMC 4270731 (freier Volltext) – (oup.com [abgerufen am 3. April 2025]).
- ↑ LPSN Species "Candidatus Nitrotoga arctica"
- ↑ LPSN Genus Nitrotoga
Genutzte Literatur
- Sabine Keuter, Hanna Koch, Katharina Sass, Simone Wegen, Natuschka Lee, Sebastian Lücker, Eva Spieck: Some like it cold: the cellular organization and physiological limits of cold‐tolerant nitrite‐oxidizing Nitrotoga. In: Environmental Microbiology. Band 24, Nr. 4, April 2022, ISSN 1462-2912, S. 2059–2077, doi:10.1111/1462-2920.15958 (wiley.com [abgerufen am 1. April 2025]).
- Mashal Alawi, André Lipski, Tina Sanders, Eva-Maria-Pfeiffer, Eva Spieck: Cultivation of a novel cold-adapted nitrite oxidizing betaproteobacterium from the Siberian Arctic. In: The ISME Journal. Band 1, Nr. 3, 1. Juli 2007, ISSN 1751-7362, S. 256–264, doi:10.1038/ismej.2007.34 (oup.com [abgerufen am 2. April 2025]).