1-Aminocyclopropancarbonsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 1-Aminocyclopropancarbonsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H7NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 101,1 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
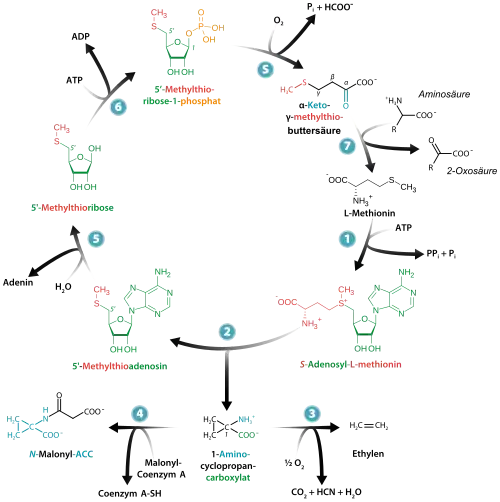
1-Aminocyclopropancarbonsäure (ACC) ist eine organische Verbindung aus der Gruppe der Cyclopropane und eine nichtproteinogene Aminosäure. Ihre biologische Bedeutung liegt insbesondere darin, dass sie ein Intermediat in der Biosynthese von Ethylen ist.
Vorkommen und biologische Bedeutung
1-Aminocyclopropancarbonsäure ist ein Intermediat in der Biosynthese des Reifungshormons Ethylen. Die Verbindung wird durch die ACC-Synthase aus S-Adenosylmethionin gebildet. Aus dem dabei anfallenden Methylthioadenosin wird wiederum Methionin und S-Adenosylmethionin zurückgewonnen.[2] Die Oxidation von 1-Aminocyclopropancarbonsäure mit Sauerstoff wird durch die ACC-Oxidase katalysiert. Dabei entstehen neben Ethylen auch Cyanwasserstoff und Kohlenstoffdioxid.[3] Daneben wurde aber auch gezeigt, dass 1-Aminocyclopropancarbonsäure selbst unabhängig von der Ethylenbildung als Signalmolekül wirkt.[4]
Synthese
Die erste Synthese von 1-Aminocyclopropancarbonsäur basierte auf der Reaktion von 1,2-Dibromethan mit Diethylmalonat zu Cyclopropan-1,1-dicarbonsäurediethylester als Schlüsselintermediat. Die Aminogruppe wurde anschließend durch eine Hofmann-Umlagerung gebildet. Eine neuere und einfachere Synthese nutzt N-Diphenylmethylidenglycinbenzylester, der mit 1-Brom-2-chlorethan umgesetzt wird. Palladiumkatalysierte Reduktion des Cyclopropan-Intermediats setzt sowohl die Carboxyl- als auch die Aminogruppe frei. Alternativ ist eine intramolekulare Cyclisierung zur Bildung des Cyclopropanrings möglich. Eine solche Synthese kann von Acrolein ausgehen. Dieses wird mit Chlorwasserstoff und Methanol zu 1,3-Dichlor-1-methoxypropan umgesetztnn mit Natriumcyanid zu einem Cyanhydrin, dessen Hydroxygruppe anschließend durch eine Aminogruppe substituiert wird. Das Amin wird mittels Benzophenonimin zu einem Imin umgesetzt. Durch basenkatalysierte Cyclisierung mit Kaliumcarbonat wird der Cyclopropanring ausgebildet, anschließend werden in mehreren Hydrolyseschritten die Nitrilgruppe zur Carboxylgruppe und die Iminfunktion zur Aminogruppe hydrolysiert.[5]
Eigenschaften
ACC wirkt als partieller Agonist am tierischen NMDA-Rezeptor.[6]
Einzelnachweise
- ↑ a b c Datenblatt 1-Aminocyclopropancarbonsäure bei Sigma-Aldrich, abgerufen am 8. März 2011 (PDF).
- ↑ Shang Fa Yang: Biosynthesis and Action of Ethylene. In: HortScience. Band 20, Nr. 1, Februar 1985, S. 41–45, doi:10.21273/HORTSCI.20.1.41.
- ↑ Izabela Ruduś, Magdalena Sasiak, Jan Kępczyński: Regulation of ethylene biosynthesis at the level of 1-aminocyclopropane-1-carboxylate oxidase (ACO) gene. In: Acta Physiologiae Plantarum. Band 35, Nr. 2, Februar 2013, S. 295–307, doi:10.1007/s11738-012-1096-6.
- ↑ Wangshu Mou, Yun-Ting Kao, Erwan Michard, Alexander A. Simon, Dongdong Li, Michael M. Wudick, Michael A. Lizzio, José A. Feijó, Caren Chang: Ethylene-independent signaling by the ethylene precursor ACC in Arabidopsis ovular pollen tube attraction. In: Nature Communications. Band 11, Nr. 1, 14. August 2020, doi:10.1038/s41467-020-17819-9, PMID 32796832, PMC 7429864 (freier Volltext).
- ↑ N. V. Yashin: Methods for the preparation of 1-Aminocyclopropanecarboxylic Acids. In: Review Journal of Chemistry. Band 8, Nr. 4, Oktober 2018, S. 373–401, doi:10.1134/S2079978018040040.
- ↑ A. Inanobe, H. Furukawa, E. Gouaux: Mechanism of Partial Agonist Action at the NR1 Subunit of NMDA Receptors. In: Neuron 47, S. 71–84 (2005)
