Cyclopropane
Cyclopropane sind eine Stoffgruppe der organischen Chemie. Sie leiten sich vom Cyclopropan ab und weisen einen gesättigten Ring aus drei Kohlenstoffatomen auf.
Vorkommen
Fettsäuren
Cyclopropanringe sind Bestandteil diverser Vertreter der Mycolsäuren. Dabei handelt es sich um Fettsäuren, die Bestandteil der Zellwand von Mykobakterien sind.[1] Viele Milchsäurebakterien bilden Lactobacillsäure und Dihydrosterculiasäure.[2] Dihydrosterculiasäure ist außerdem ein Intermediat in der Biosynthese von Sterculiasäure, einer der Hauptfettsäuren von Sterculia foetida, die einen ungesättigten Cyclopropenring aufweist.[3]
Aminosäuren
1-Aminocyclopropancarbonsäure ist ein Intermediat in der Biosynthese des Pflanzenhormons Ethylen.[4] Coprin und Hypoglycin sind zwei giftige Aminosäuren, die je einen Cyclopropanring enthalten. Coprin kommt im Falten-Tintling vor und ist ein Inhibitor der Acetaldehyd-Dehydrogenase. Dadurch ist der Pilz bei gleichzeitigem Konsum von Alkohol giftig.[5] Hypoglycin kommt in den Früchten der Akee-Pflanze vor. Seine Toxizität basiert auf der Bildung eines Coenzym-A-Derivats, das Acyl-CoA-Dehydrogenasen inhibiert. Dadurch werden der Metabolismus von Fettsäuren und die Gluconeogenese gestört, was zu einer potentiell tödlichen Hypoglykämie führen kann.[6]
Terpene
Cyclopropanringe kommen in verschiedenen Terpenen vor und werden vermutlich überwiegend durch kationische Zwischenstufen gebildet, unter anderem im Falle der Thujene, 3-Thujole oder α-Sabinen. Beispielsweise geht die Biosynthese von α-Thujen von Geranylpyrophosphat aus; der Cyclopropanring wird durch die Umlagerung eines Carbeniumions gebildet. Eine ähnliche Biosynthese wird auch bei Illudin M und verwandten Verbindungen vermutet. Hingegen wird Presqualen-Pyrophoshphat (ein Intermediat in der Biosynthese von Cholesterin und Steroiden) und sein Cyclopropanring durch Kondensation von zwei Einheiten Farnesylpyrophosphat gebildet. Im Falle von Cycloartenol wird für die Bildung des Cyclopropanrings die Reaktion eines kationischen Zentrums mit einer benachbarten Methylgruppe vermutet.[7]
Weitere Naturstoffe
Ein Naturstoff aus Streptomyces, der insgesamt sechs Cyclopropanringe enthält, ist U-106305.[8] Die natürlichen Insektizide aus der Gruppe der Pyrethrine aus der Dalmatinischen Insektenblume enthalten ebenfalls einen Cyclopropanring.[9]
-
 Akee-Frucht
Akee-Frucht -
 Hypoglycin
Hypoglycin -
 Falten-Tintling
Falten-Tintling -
 Coprin
Coprin -
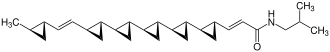 U-106305
U-106305
Synthese
Die Bildung eines Cyclopropanrings wird als Cyclopropanierung bezeichnet. Dazu werden verschiedene Reaktionen eingesetzt. Wichtige Methoden sind die Simmons-Smith-Reaktion, die Corey-Chaykovsky-Reaktion sowie Reaktionen unter Einsatz von Diazoverbindungen.
Simmons-Smith-Reaktion
Bei der Simmons-Smith-Reaktion wird ein Alken mit Diiodmethan und Zink-Kupfer-Paar umgesetzt. Diese reagieren zu einer Organozink-Verbindung, die analog einer Grignard-Verbindung aufgebaut ist. Diese reagiert wiederum analog zu einem Carben in einer einstufigen Reaktion unter Übertragung einer Methylengruppe zu einem Cyclopropan. Bei chiralen Substraten erfolgt die Addition meist stereospezifisch von der weniger gehinderten Seite, es sei denn es liegt beispielsweise eine Hydroxygruppe vor, an die das Zink koordinieren kann.[10] Die Reaktion kann auch in mehreren abgeleiteten Varianten, darunter die Furukawa-Prozedur mit Diethylzink und Diiodmethan und die Sawada-Prozedur mit Ethylzinkiodid und Diiodmethan.[11] Die Charette-Cyclopropanierung ist eine Variante, die 2-Butyl-4,5-bis(dimethylaminocarbonyl)-1,3-dioxaborolan als chirales Auxiliar einsetzt. Sie wurde beispielsweise in der Totalsynthese von U-106305 eingesetzt, das insgesamt sechs Cyclopropanringe enthält.[12]
Diazoverbindungen
In Gegenwart bestimmter Übergangsmetalle, insbesondere Palladium können Diazoverbindungen Alkene cyclopropanieren. Dies funktioniert beispielsweise mit Diazomethan, Trimethylsilyldiazomethan und Phenyldiazomethan. Palladiumkatalysatoren, die mit Diazomethan eingesetzt wurden, sind beispielsweise Palladium(II)-acetylacetonat, Tris(dibenzylidenaceton)dipalladium und Palladium(II)-acetat. Verbreitet ist auch die Verwendung von Diazoverbindungen mit einem elektronenziehenden Substituenten, beispielsweise Ethyldiazoacetat. Bei elektronenarmen Alkenen eignen sich hier ebenfalls Palladium-Katalysatoren wie Palladium(II)-acetat, bei elektronenreichen Doppelbindungen eignen sich Rhodium, Ruthenium, Cobalt und Kupfer. Geeignete Katalysatoren sind zum Beispiel Kupfer(I)-triflat und Rhodium(II)-acetat.[13]
Corey-Chaykovsky-Reaktion
Bei der Corey-Chaykovsky-Reaktion wird ein Sulfonium-Ylid an eine Doppelbindung addiert. Handelt es sich um eine C=C-Doppelbindung, wird so ein Cyclopropan erhalten. Typische Reagenzien sind Dimethylsulfoxoniummethylid und Dimethylsulfoniummethylid.[14]
Intramolekulare Cyclisierung
Cyclopropane können auch durch die Freund-Reaktion hergestellt werden, indem eine 1,3-Dihalogenverbindung mit Natrium, Magnesium oder Zink umgesetzt wird. Die Reaktion verläuft vermutlich über einen radikalischen Mechanismus, ähnlich der Wurtzschen Synthese.[15] Bestimmte Moleküle können unter Einwirkung von Samarium(II)-iodid in einer radikalischen Reaktion 3-exo-trig (siehe Baldwin-Regeln) unter Bildung eines Cyclopropans cyclisieren.[16]
Sonstige Synthesemethoden
Bei der Kishner-Reaktion geht die Synthese von einer α,β-ungesättigten Carbonylverbindung aus. Dieses wird zunächst mit Hydrazin zu einem Pyrazolin umgesetzt. Unter Erhitzung wird molekularer Stickstoff abgespalten und in einer Ringverengungsreaktion ein Cyclopropan gebildet.[17] Bei der Kulinkovich-Reaktion wird die Carbonylgruppe eines Esters durch Reaktion mit Tetraisopropylorthotitanat und Ethylmagnesiumbromid durch einen Cyclopropanring ersetzt.[18]
Weblinks
Einzelnachweise
- ↑ Hedia Marrakchi, Marie-Antoinette Lanéelle, Mamadou Daffé: Mycolic Acids: Structures, Biosynthesis, and Beyond. In: Chemistry & Biology. Band 21, Nr. 1, Januar 2014, S. 67–85, doi:10.1016/j.chembiol.2013.11.011.
- ↑ T Johnsson, P Nikkila, L Toivonen, H Rosenqvist, S Laakso: Cellular Fatty Acid profiles of lactobacillus and lactococcus strains in relation to the oleic Acid content of the cultivation medium. In: Applied and Environmental Microbiology. Band 61, Nr. 12, Dezember 1995, S. 4497–4499, doi:10.1128/aem.61.12.4497-4499.1995, PMID 16535200, PMC 1388665 (freier Volltext).
- ↑ Xiaoming Bao, Sue Katz, Mike Pollard, John Ohlrogge: Carbocyclic fatty acids in plants: Biochemical and molecular genetic characterization of cyclopropane fatty acid synthesis of Sterculia foetida. In: Proceedings of the National Academy of Sciences. Band 99, Nr. 10, 14. Mai 2002, S. 7172–7177, doi:10.1073/pnas.092152999, PMID 11997456, PMC 124547 (freier Volltext).
- ↑ Shang Fa Yang: Biosynthesis and Action of Ethylene. In: HortScience. Band 20, Nr. 1, Februar 1985, S. 41–45, doi:10.21273/HORTSCI.20.1.41.
- ↑ Jeffrey S. Wiseman, Robert H. Abeles: Mechanism of inhibition of aldehyde dehydrogenase by cyclopropanone hydrate and the mushroom toxin coprine. In: Biochemistry. Band 18, Nr. 3, 6. Februar 1979, ISSN 0006-2960, S. 427–435, doi:10.1021/bi00570a006.
- ↑ H.S.A. Sherratt: Hypoglycin, the famous toxin of the unripe Jamaican ackee fruit. In: Trends in Pharmacological Sciences. Band 7, Januar 1986, S. 186–191, doi:10.1016/0165-6147(86)90310-X.
- ↑ Ludger A. Wessjohann, Wolfgang Brandt, Thies Thiemann: Biosynthesis and Metabolism of Cyclopropane Rings in Natural Compounds. In: Chemical Reviews. Band 103, Nr. 4, 1. April 2003, S. 1625–1648, doi:10.1021/cr0100188.
- ↑ M. S. Kuo, R. J. Zielinski, J. I. Cialdella, C. K. Marschke, M. J. Dupuis, G. P. Li, D. A. Kloosterman, C. H. Spilman, V. P. Marshall: Discovery, isolation, structure elucidation, and biosynthesis of U-106305, a cholesteryl ester transfer protein inhibitor from UC 11136. In: Journal of the American Chemical Society. Band 117, Nr. 43, November 1995, S. 10629–10634, doi:10.1021/ja00148a004.
- ↑ Leslie Crombie: Chemistry and biosynthesis of natural pyrethrins. In: Pesticide Science. Band 11, Nr. 2, April 1980, ISSN 0031-613X, S. 102–118, doi:10.1002/ps.2780110203 (wiley.com [abgerufen am 11. September 2025]).
- ↑ Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. Springer-Verlag, 2013, ISBN 978-3-322-96805-0, S. 307–308 (google.de [abgerufen am 5. Juni 2025]).
- ↑ Mikio Nakaniwa, Kazuo Ozaki, Junji Furukawa: Study of diethylzinc/water catalyst system. In: Die Makromolekulare Chemie. Band 138, Nr. 1, 15. Oktober 1970, S. 63–65, doi:10.1002/macp.1970.021380120.
- ↑ Hans-Günther Schmalz, Thomas Wirth: Organic Synthesis Highlights V. John Wiley & Sons, 2008, ISBN 978-3-527-62049-4, S. 429–430 (google.de [abgerufen am 5. Juni 2025]).
- ↑ Hélène Lebel, Jean-François Marcoux, Carmela Molinaro, André B. Charette: Stereoselective Cyclopropanation Reactions. In: Chemical Reviews. Band 103, Nr. 4, 1. April 2003, S. 977–1050, doi:10.1021/cr010007e.
- ↑ Jie Jack Li: Corey –Chaykovsky-Reaktion. In: Namensreaktionen. Springer Nature Switzerland, Cham 2024, ISBN 978-3-03152849-1, S. 135–137, doi:10.1007/978-3-031-52850-7_35 (springer.com [abgerufen am 5. September 2025]).
- ↑ Jie Jack Li: Name Reactions for Carbocyclic Ring Formations. John Wiley & Sons, 2010, ISBN 978-0-470-87220-8, S. 2–5 (google.de [abgerufen am 5. September 2025]).
- ↑ Chama Cammoun, Riadh Zriba, Sophie Bezzenine-Lafollée, François Guibé: Reactivity of cyclopropanic δ-oxo-α,β-unsaturated esters towards SmI2: 3-exo-trig cyclisation versus cyclopropane ring opening. In: Tetrahedron. Band 63, Nr. 18, April 2007, S. 3728–3736, doi:10.1016/j.tet.2007.02.080.
- ↑ Jie Jack Li: Name Reactions for Carbocyclic Ring Formations. John Wiley & Sons, 2010, ISBN 978-0-470-87220-8, S. 7–8 (google.de [abgerufen am 5. September 2025]).
- ↑ Jie Jack Li: Name Reactions for Carbocyclic Ring Formations. John Wiley & Sons, 2010, ISBN 978-0-470-87220-8, S. 14–15 (google.de [abgerufen am 5. September 2025]).