8-Chlortheophyllin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 8-Chlortheophyllin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C7H7ClN4O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 214,61 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
8-Chlortheophyllin, auch bekannt als 1,3-Dimethyl-8-chlorxanthin, ist ein Stimulans aus der chemischen Klasse der Xanthine mit koffeinähnlichen physiologischen Wirkungen[4] und wird hauptsächlich in dem Antiemetikum Dimenhydrinat, einem Salz, als Gegenion zu Diphenhydramin verwendet. Dimenhydrinat dissoziiert nach oraler oder rektaler Gabe im Blut vollständig in seine beiden Bestandteile. Die antiemetische Wirkung beruht auf Diphenhydramin, während das milde Psychostimulans 8-Chlortheophyllin die sedativen Effekte des Antihistaminikums aufheben soll. Trotzdem hat Dimenhydrinat sehr häufig sedierende Nebenwirkungen, was darauf hindeutet, dass 8-Chlortheophyllin keine signifikante antisedative Wirkung hat.[5]
Im Tierversuch rief es bei Mäusen im Allgemeinen keine über der Kontrolle liegende Bewegungsaktivität hervor und scheint die Blut-Hirn-Schranke nicht gut zu passieren.
Ein weiteres Salz des 8-Chlortheophyllins ist Promethazinteoclat.[6]
Darstellung
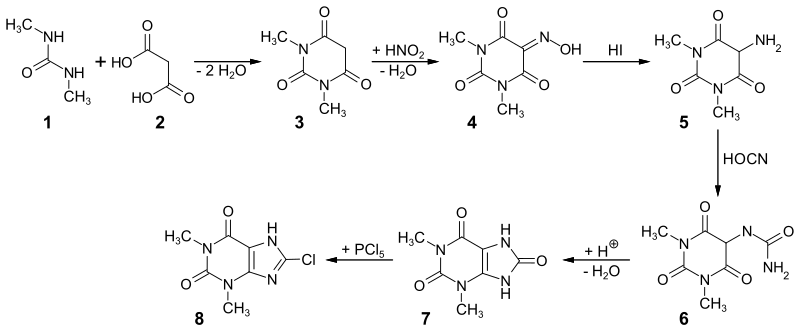
8-Chlortheophyllin erhält man über mehrere Stufen aus N,N′-Dimethylharnstoff 1 und Malonsäure 2. Im ersten Schritt werden die beiden Ausgangsstoffe zur Dimethylbarbitursäure 3 kondensiert. Durch Reaktion mit salpetriger Säure erhält man die 1,3-Dimethylviolursäure 4, die mit Iodwasserstoff zum Dimethyluramil 5 reduziert wird. Die Umsetzung mit Cyanursäure liefert Harnstoffderivat 6, das beim Erhitzen mit Mineralsäuren in die 1,3-Dimethylharnsäure[7] 7 übergeht. Durch die Umsetzung mit Phosphorpentachlorid und Phosphoroxychlorid erhält man 8-Chlortheophyllin 8.[8]
Einzelnachweise
- ↑ a b Eintrag zu C0293 8-Chlorotheophylline bei TCI Europe, abgerufen am 19. Dezember 2021.
- ↑ a b c Curt Hunnius: Hunnius pharmazeutisches Wörterbuch. Walter de Gruyter GmbH & Co KG, 2020, ISBN 978-3-11-086901-9, S. 327 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt 8-Chlortheophyllin bei Sigma-Aldrich, abgerufen am 19. Dezember 2021 (PDF).
- ↑ S. H. Snyder, J. J. Katims, Z. Annau, R. F. Bruns, J. W. Daly: Adenosine receptors and behavioral actions of methylxanthines. In: Proceedings of the National Academy of Sciences of the United States of America. Band 78, Nr. 5, Mai 1981, S. 3260–3264, doi:10.1073/pnas.78.5.3260, PMID 6265942.
- ↑ Ulrich Schwabe, Dieter Paffrath, Wolf-Dieter Ludwig, Jürgen Klauber: Arzneiverordnungs-Report 2019. Springer-Verlag, 2019, ISBN 978-3-662-59046-1, S. 492 (books.google.com).
- ↑ Drugbank, abgerufen am 16. Juni 2025
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,3-Dimethylharnsäure: CAS-Nr.: 944-73-0, EG-Nr.: 213-410-1, ECHA-InfoCard: 100.012.191, PubChem: 70346, ChemSpider: 63527, Wikidata: Q27136946.
- ↑ W. Brandt, A. Braun, R. Brieger, H. Dieterle, R. Dietzel, W. Moeser, P. N. Schürhoff, F. Stadlmayr, O. Wiegand: Kommentar zum Deutschen Arzneibuch 6. Ausgabe 1926: Auf Grundlage der Hager-Fischer-Hartwichschen Kommentare der früheren Arzneibücher Zweiter Band. Springer-Verlag, 2013, ISBN 978-3-642-90746-3, S. 586 (eingeschränkte Vorschau in der Google-Buchsuche).
