Hydroxymethylfurfural
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
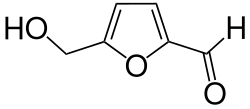
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Hydroxymethylfurfural | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H6O3 | |||||||||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 126,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,243 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
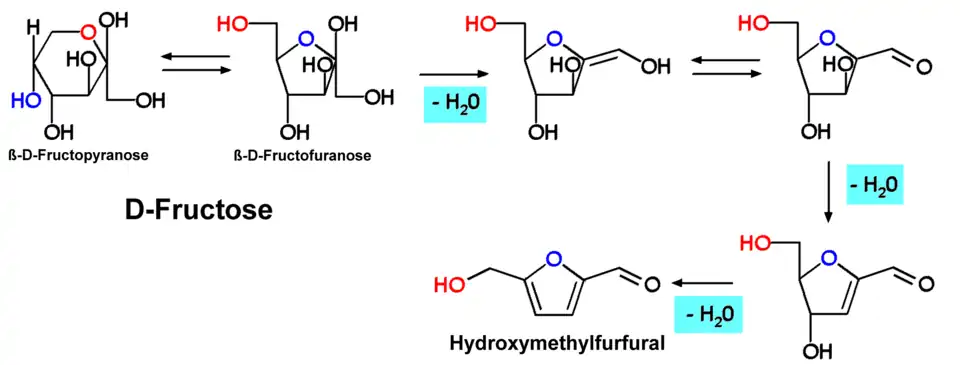
Hydroxymethylfurfural, 5-HMF oder 5-(Hydroxymethyl)furfural, auch 5-Oxymethylfurfurol, ist eine Aldehyd- und Furanverbindung, die sich bei der nicht-enzymatischen, thermischen Zersetzung von Zucker oder Kohlenhydraten bildet und dient daher als Indikator für die Erhitzung von Lebensmitteln. HMF kann in vielen mit Hitze behandelten Lebensmitteln einschließlich Milch, Fruchtsaft, alkoholischen Getränken, Honig usw. nachgewiesen werden. Hexosen, insbesondere Fructose, bilden durch eine mehrfache (säurekatalysierte) Dehydratisierung das HMF. 5-HMF kann in der Medizin als Antioxidans und Ammoniak-Eliminierer die Aktivität der Mitochondrien verbessern. Es ist Ausgangsprodukt für Biopolymere. 5-HMF ist Kleberzusatz in der Reifenindustrie. Als Plattformchemikalie kann es an der Hydroxygruppe, an der Aldehydgruppe und am Furan-Ring reagieren. Es hat Potential als Amphiphile und Kationische Tenside.
Geschichte
Die organische Verbindung 5-HMF oder 5-(Hydroxymethyl)furfural wurde 1895 erstmals von G. Düll durch die Dehydratisierung von Fructose bzw. Saccharose mit Oxalsäure und unabhängig davon durch J. Kiermeyer hergestellt.[3][4] Des Weiteren beobachtete der französischen Chemiker Louis Maillard 1912 im Rahmen seiner Forschungsarbeit über nicht enzymatische Reaktionen von Glucose und Lysin dessen Bildung bei der nach ihm benannten „Maillard-Reaktion“.[5]
Die Maillard-Reaktion ist eine chemische Reaktion zwischen Aminosäuren und reduzierenden Zuckern, die gebräunten Lebensmitteln ihren unverwechselbaren Geschmack verleiht. Die Reaktion ist eine Form der nicht-enzymatischen Bräunung, die typischerweise schnell von etwa 140 bis 165 °C (280 bis 330 °F) fortschreitet. Bei höheren Temperaturen werden die Karamellisierung (Bräunung von Zucker, ein ausgeprägter Prozess) und anschließend die Pyrolyse (endgültiger Abbau, der zur Verbrennung führt) ausgeprägter. Eines der Endprodukte der Maillard-Reaktion ist 5-Hydroxymethylfurfural (5-HMF).[6]
Wenn Fructose erhitzt wird, bildet sich aus Fruchtzucker HMF.
Vorkommen
Hydroxymethylfurfural (HMF) ist in natürlichen Lebensmitteln nicht vorhanden. Diese Substanz entsteht erst bei der thermischen Zersetzung von Kohlenhydraten. Hexosen, insbesondere Fructose, bilden durch eine mehrfache (säurekatalysierte) Dehydratisierung das HMF.
5-HMF in Honig
Der HMF-Gehalt in frisch geschleudertem Honig ist sehr gering und steigt bei korrekter Lagerung, je nach pH-Wert und Lagertemperatur um ca. 2–3 mg/kg pro Jahr an. Lagerung bei Zimmertemperatur (21 °C) kann den HMF-Gehalt in einem Jahr bereits auf 20 mg/kg erhöhen. Ein hoher 5-HMF-Wert des Honigs weist auf länger anhaltende Lagerung oder Erwärmung hin. Die EU hat einen HMF-Grenzwert von maximal 40 mg/kg für Honig, der unter europäischen Bedingungen produziert wurde, festgelegt. Einige nationale Imkerverbände fordern sogar noch niedrigere Werte, z. B. erlaubt der Deutsche Imkerbund höchstens 15 mg/kg für sein Gütesiegel „Echter Deutscher Honig“.[7]
5-HMF-Gehalte sonstiger Lebensmittel
5-HMF kann in vielen mit Hitze behandelten Lebensmitteln nachgewiesen werden. 5-HMF bildet sich bei der nicht-enzymatischen, thermischen Zersetzung von Zucker oder Kohlenhydraten. Es dient daher als Indikator für die Erhitzung von Lebensmitteln. (Maillard-Reaktion).
5-HMF kommt natürlich vor und wurde in Honig, Apfelsaft, Zitrusfruchtsäften, Bier, Weinbrand, Milch, Frühstücksflocken, Backwaren, Tomatenprodukten und hausgemachten Zubereitungen von Zucker und Kohlenhydraten identifiziert. Die Hauptaufnahme erfolge über den Genuss von Kaffee.
HMF wird leicht aus Lebensmitteln über den Magen-Darm-Trakt aufgenommen und wird nach der Umwandlung in verschiedene Derivate über den Urin ausgeschieden.
Tabelle 1: 5-HMF-Gehalte verschiedener Lebensmittel in mg/kg [8]
| Lebensmittel | Gehalt in mg/kg (Mittelwert) | Gehalt in mg/kg (Höchstwert) |
| Traubensaft | 6 | 13 |
| Apfelsaft | 7 | 37 |
| Honig | 9 | 16 |
| Müsliriegel | 36 | 213 |
| Roggenmischbrot | 44 | 147 |
| Gebrannte Mandeln (dragiert) | 156 | 351 |
| Kaffee aus gerösteten Bohnen | 300 | 2900 |
| Löslicher Kaffee (Pulverform) | 286 | 548 |
| Trockenpflaumen, gedörrt | 351 | 910 |
Geschmackstoff und Konservierung
Beim Kochen, Backen oder anderen thermischen Behandlungen durchlaufen Zucker wie Glucose und Fructose komplexe chemische Reaktionen, die zur Bildung von HMF führen. Die Maillard-Reaktion, die auftritt, wenn Aminosäuren bei erhöhten Temperaturen mit reduzierenden Zuckern reagieren, ist für die Bildung von HMF und anderen Aromastoffen verantwortlich. 5-Hydroxymethylfurfural (HMF) trägt wesentlich zu den reichhaltigen, süßen, gerösteten oder karamellartigen Noten in wärmebehandelten Produkten wie Sirupen, Süßigkeiten, Backwaren, gebratenen Fischen, Bratapfel und sogar geröstetem Kaffee bei.
Da Lebensmittel beim Kochen oder Rösten braun werden, trägt HMF zur Tiefe der Karamellfarbe und zur Komplexität der Aromen bei und liefert einen charakteristischen und reichhaltigen Geschmack.
Neben dem Aroma wird HMF einige konservierende Eigenschaften zugeschrieben. Forschungen deuten darauf hin, dass HMF antimikrobielle Eigenschaften besitzen kann, die möglicherweise das Wachstum bestimmter Bakterien und Pilze in Lebensmitteln hemmen könnten. Die konservierende Wirkung von HMF ist jedoch nicht vollständig verstanden, und seine Verwendung als Konservierungsmittel würde weitere Forschung erfordern, um seine Wirksamkeit im Vergleich zu etablierten Konservierungsmitteln zu validieren.[9]
Herstellung, Synthese und Nachweis
Synthesewege
Die Bildung von Hydroxymethylfurfural wurde unter anderem im Verlauf einer Karamellisierung von Hexosen (z. B. Fructose, Maltose, Glucose) beobachtet. Der Bildungsmechanismus entspricht dem bei Pentosen zu Furfural führenden Schema.
Auch polymere Zucker wie Stärke oder Cellulose zeigen diese Reaktion. Es ist bekannt, dass sich Hexosen durch die Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung ineinander umwandeln können. Beim Rösten von Zichorienwurzel zur Herstellung von Ersatzkaffee wird Inulin teilweise zu Hydroxymethylfurfural umgewandelt, das für das kaffeeähnliche Aroma sorgt.[10]
5-HMF wird durch säurekatalysierte Eliminierung von drei Wassermolekülen aus Hexosen hergestellt. Die Reaktion wird von einer Reihe anderer Nebenreaktionen begleitet, die zur Bildung von löslichen und unlöslichen Huminen durch Zersetzung der Zucker oder Reaktionen zwischen 5-HMF-Molekülen und mit Zuckermolekülen führen, während organische Säuren einschließlich Lävulinsäure und Ameisensäure durch Rehydratation von 5-HMF gebildet werden. Hohe Ausbeuten an 5-HMF (60–91 %) aus Fructose (10 % w/v) werden in einphasigen Systemen mit Dimethylsulfoxid (DMSO), N-Methyl-2-pyrrolidon (NMP) als Lösungsmittel bei 95–110 °C berichtet.[11]
In einem zweiphasigen System wurde ein Wasser/Dimethylcarbonat (DMC)-System (1:3) für die säurekatalysierte Fruktose-Dehydratisierung im kontinuierlichen Modus unter Verwendung von 0,23 M HCl als Katalysator ausgewählt. Das Verfahren in einem Mini-Rohrreaktor mit 1 Minute Verweilzeit und einem Druck von 20 bar, bei dem 30 % (w/v) Fruktose in Wasser mit dem dreifachen Volumen von DMC bei 200 °C verwendet wurde, ergab eine Fruktoseumwandlung von 96,5 % und eine 5-HMF-Ausbeute von 87,2 % mit einer Selektivität von 85,5 % bzw. 95,8 % in wässriger und organischer Phase. Eine kurze Verweilzeit im Rohrreaktor minimiert das Risiko unspezifischer Reaktionen von Huminbildung und Rehydrationsreaktionen und führt somit zu einer höheren Produktselektivität.[11]
In einer einstufigen Synthese kann Cellulose in Gegenwart von gekoppelten Kupfer(II)-chlorid/Chrom(II)-chlorid-Katalysatoren in der ionischen Flüssigkeit 1-Ethyl-3-methylimidazoliumchlorid als Lösungsmittel bei 80–120 °C zu 5-Hydroxymethylfurfural (HMF) umgesetzt werden. Unter diesen Bedingungen verläuft die Synthese etwa zehnmal schneller als bei einer herkömmlichen säurekatalysierten Hydrolyse.[12]
Nachweis
HMF wird meistens mittels Hochleistungsflüssigkeitschromatographie[13][14][11] oder photometrisch mit dem sogenannten Winkler-Verfahren[7] nachgewiesen.
Seit 2009 ist ein Schnelltest von der Merck KGaA zur Bestimmung von HMF (in Honig) erhältlich. Das Reflectoquant® System ermöglicht eine schnelle Gehaltsanalyse, z. B. von Glucose und Fructose oder von Hydroxymethylfurfural (HMF). Bei dem „Reflectoquant® HMF“ genannten Test wird eine geringe Menge Honig im Verhältnis 1:4 mit destilliertem Wasser verdünnt, ein Teststreifen in die Probe getaucht und dann in einem RQflex-Reflektometer gemessen.
Produktion von 5-HMF
Seit 2014 produziert das in der Schweiz ansässige Unternehmen „Avalon Industries (AVA Biochem)“ die biobasierte Plattformchemikalie 5-Hydroxymethylfurfural (5-HMF) im 300 Tonnen/Jahr-Maßstab. Das hochreine 5-HMF dient als Spezialchemikalie für Forschungszwecke und in technischer Qualität um Anwendungen für den Markt in der Massenchemie zu ermitteln.[15][16]
Die Tochter „Resicare“ des Reifenherstellers „Michelin“ baut unter dem Projektnamen „Cerisea“ im Süden von Lyon ein 60 Millionen Euro teures Werk für die 5-HMF-Produktion auf und will es Ende 2026 in Betrieb nehmen. Die Anlage soll jährlich 3.000 Tonnen des vielseitig einsetzbaren Grundstoffs 5-HMF, gewonnen aus Fructose, herstellen können.[17][18]
Sicherheit und Toxizität
Das Bundesinstitut für Risikobewertung bemerkte, dass 5-HMF-Gehalte in Lebensmitteln „nach derzeitigem wissenschaftlichen Kenntnisstand gesundheitlich unproblematisch“ wären.[1][8][19]
Verwendung von 5-HMF
Medizinische Verwendung von 5-Hydroxymethylfurfural
HMF kann für die menschliche Gesundheit vorteilhaft sein, indem es anti-oxidative, anti-allergische, entzündungshemmende, anti-hypoxische, anti-sickelnde (Sichelzellenanämie) und anti-hyperurikämische (Gicht) Effekte bietet.
In den Körperzellen wandeln Mitochondrien Nahrung in Energie um. In den Mitochondrien entstehen dabei als Nebenprodukt der Zellatmung auch reaktive Sauerstoffradikale (Peroxide, Peroxinitrit). Diese RONS und RNS führen in den Zellen zu oxidativem Stress. Oxidativer Stress bedeutet, dass die Mitochondrien nicht mehr gut arbeiten können und dann viele Schadstoffe, die eigentlich wieder in Energie umgewandelt werden sollen, in die Umgebung ableiten und diese Schadstoffe unsere Zellen schädigen.
Die Aktivität der Mitochondrien wird von Zuständen in unserem Leben beeinflusst und führt zu verminderter Leistungsfähigkeit. Zu den Lebenszuständen gehören zum Beispiel Stress (physisch und psychisch), Traumata (physisch und psychisch), Operationen (Vor- und Nachsorge), Leistungssport / Regeneration, chronische Müdigkeit, Abgeschlagenheit, Anfälligkeit für Erkrankungen wie Burn-out, Depressionen etc.
5-HMF setzt die Peroxidproduktion in der inneren mitochondrialen Membran in der Nähe des Ubichinon-Komplexes zu H2O, CO2 und der oxidativen Form Succinat um. 5-HMF gibt unseren Mitochondrien einen Energieschub und kann deshalb hohe positive Auswirkungen auf unser Allgemeinbefinden und auf die Regeneration haben; zum Beispiel bei Stress (physisch und psychisch), Traumata (physisch und psychisch), Operationen (Vor- und Nachsorge), Leistungssport / Regeneration, chronische Müdigkeit, Burnout, Depressionen.[2]
5-HMF erhöht effektiv einen speziellen Singulett-Sauerstofftransport, Sättigung, Aufnahme und Energieproduktion in den Zellen.
Die Hauptaufgabe von 5-HMF ist es auch, Ammoniak/Amine kovalent zu eliminieren. 5-HMF bindet kovalent Ammoniak und Amine. Aufgrund dieses Mechanismus wird angenommen, dass 5-HMF synergistisch mit AKG wirkt. 5-HMF ist eine sehr wirksame, nicht-enzymatisch kontrollierte Entgiftungssubstanz von Ammoniak, die Azomethin-Derivate bildet und direkt durch Harnstoff entfernt wird (z. B. Abtransport von Ammoniak aus dem Gehirn).
HMF entfernt den durch den Abbau von Aminosäuren freigesetzten Stickstoff (Ausgleich der körpereigenen Stickstoffchemie und Vermeidung einer Stickstoffüberlastung).
5-HMF reagiert mit reaktiven Stickstoffspezies (RNS), wie Peroxynitrit. Das Peroxynitrit ist ein stark oxidierendes und desaminierendes Mittel aus Nukleotiden sowie OH-Radikalen und Nitrit, die durch den Abbau von Peroxynitrit gebildet werden, ähnlich wie giftige Nitrosamine. Auf diese Weise schützt 5-HMF die Membranen gesunder Zellen vor den zerstörerischen Auswirkungen dieser reaktiven Spezies.
Darüber hinaus wurde beobachtet, dass HMF eine schwache Wirkung auf die Einführung von Chinon-Reduktase zeigt.[2]
5-HMF wird im Körper nicht gebildet und muss durch externe Aufnahme zugeführt werden, um von seinen ihm zugesprochenen, positiven Auswirkungen profitieren zu können. Je nach Literatur finden sich folgende, beschriebene, positive Effekte:[2]
- Gebesserte Leistungsfähigkeit und Abbau von oxidativem Stress in der Lungenchirurgie (Matzi et al. 2007)
- Milderung durch Alzheimer bedingter Hirnschäden bei Mäusen (Aijing et al. 2014)
- 5-Hydroxymethylfurfural und Alpha-Ketoglutarsäure als leistungssteigernde Unterstützung bei intensiviertem Fußballtraining (Gatterer et al. 2020)
- Entfernung von Ammoniak aus dem Gehirn (Fischer, 2020)
- akG und 5-HMF: eine potenzielle anti-tumorale Kombination gegen Leukämie-Zellen (Greilberger, Herwig et al. 2021)
- Dosis- und geschlechtsabhängige Veränderungen der Hämoglobin-Sauerstoff-Affinität durch aKG und 5-HMF (Woyke et al. 2021)
- Gesteigerte, antivirale Immunantwort in Makrophagen (Zou et al. 2021)
- Therapieschema im multimodalen Setting bei Spike-Protein-assoziierten Erkrankungsbildern (Poglitsch et al. 2022)
- Unterschiedliche RONS in Schilddrüsenkarzinom-Zellen und nicht kleinzelligen Lungenkarzinom-Zellen führen zu unterschiedlichen antitumoralen Wirkungen von aKG und 5-HMF (Greilberger, Herwig et al. 2023).[2]
Mode of Action – intrazellulär
5-HMF zeigt potenziell antioxidative Eigenschaften auf molekularer, zellulärer und genetischer Ebene. 5-HMF ist als ein starkes Antioxidans bekannt, das in der Lage ist, radikale Elektronen in einer stabilen Form innerhalb seiner Struktur zu halten. Damit ist 5-HMF in der Lage, „klassische“ Antioxidanzien, wie zum Beispiel bei Vitamin C von einem Ascorbatradikal (nach dem anti-Oxidationsvorgang) zum Vitamin C zurückzuwandeln.
Vier Arten von freien Radikalen wurden ausgewählt, um die Fangleistung von 5-HMF zu beurteilen, darunter der stickstoffabgeleitete Rest DPPH, sauerstoffabgeleitete Hydroxyl- und Superoxid-Anionenreste und kohlenstoffabgeleitete Alkylreste. 5-HMF hatte die stärkste fangende Aktivität am Hydroxylrest bei IC50 22,8 μM, verglichen mit dem relativ schwachen Alkylrest bei IC50 45,0 μM. 5-HMF zeigte eine signifikante Potenz (p<0,05) beim Abfangen von Hydroxylradikalen in verschiedenen Konzentrationen, mit Abfrageanteilen von 92 % (100 μM), 62 % (25 μM), 30 % (10 μM) und 7 % (1 μM). Der IC50-Wert von 5-HMF wurde mit 22,8 μM berechnet. In Bezug auf die Struktur von 5-HMF enthält es einige interessante funktionelle reaktive Gruppen wie Doppelbindungen, ein Aldehyd-Sauerstoffatom und einen weiteren im Furanring vorhandenen Sauerstoff, der Elektronen leicht anziehen kann; außerdem kann eine Hydroxygruppe auch nach der Abgabe eines Wasserstoffions einen Singulett-Sauerstoff bilden. Diese Merkmale sollten die Hauptfaktoren für seine antioxidative Aktivität sein, indem sie übermäßig produzierende freie Radikale im Körper abfangen und die Aktivität des Oxidationsenzyms (MPO) verringern oder die Fähigkeit der antioxidativen Enzyme Glutathion (GSH) und Superoxiddismutase (SOD) auf Genebene erhöhen.[20] Die folgenden Eigenschaften von 5-HMF wurden systematisch ausgewertet: seine antioxidativen Aktivitäten; Membranproteinoxidation; oxidative Enzymmyeloperoxidase (MPO)-Hemmung; sowie Expressionen von selenhaltigen antioxidativen Enzymen Glutathion (GSH) und Superoxiddismutase (SOD) auf Genebene. Die antioxidative Aktivität von 5-HMF wird durch direktes Abfangen von zellulärem ROS verursacht, und deshalb kann 5-HMF als potenter Antioxidanskandidat zur Hemmung der zellulären ROS-Bildung entwickelt werden. Jüngste Ergebnisse belegen die hemmende Wirkung von 5 HMF auf die Nitrierung von Tyrosinen durch Peroxynitrit.[21]
Mode of Action – intra- und extrazellulär
Durch die Struktur von 5-HMF ist es nicht nur ein besonders stabiles Pseudoaroma, sondern verfügt durch seine Carbonylgruppe über ein durchkonjugiertes Resonanzsystem. So kann 5-HMF in seinem umfangreichen Resonanzsystem, das langlebige Radikale bildet, radikale Elektronen (z. B. Peroxynitrit) stabil halten. Ein weiterer positiver Effekt ist die Eliminierung von ONOO- (Peroxynitrit), einem stark oxidierenden und desaminierenden Mittel für Nukleotide und von OH*-Radikalen (nach Abbau von Peroxynitrit), das Membranen gesunder Zellen zerstört. 5-HMF wurde als ein neu gefundener Wirkstoff identifiziert, der die Chinon-Reduktase (QR) induziert. Dies ist ein bekanntes Entgiftungsenzym der Phase.[22]
Vergleich 5-HMF vs. Vitamine
Antioxidantien wie Vitamin C und E reagieren mit allen freien Radikalen, d. h. auch in situ „essentielle“ Radikale (Immunabwehr), was zu vielen Dysfunktionen führt. 5-HMF eliminiert überwiegend hochreaktive Stickstoffarten (RNS) (z. B. Peroxide), nicht aber die „Essentiellen“. In ihrer Funktion, freie Radikale zu entfernen, wenden sie sich an hochpotenzielle Substanzen (z. B. Vitamin C Radikal). Diese Stoffe können auch unkontrollierte Funktionsstörungen verursachen (z. B. NOS-Dysfunktion).
5-Hydroxymethylfurfural in der Chirurgie
Präoperative Mikronährstoffergänzungen in Fast-Track-Chirurgieprogrammen haben gezeigt, dass sie Komplikationen reduzieren, die Regeneration verkürzen und damit die Kosten senken. Die metabolischen Effekte einer Kombination aus α-Ketoglutarsäure (AKG) und 5-Hydroxymethylfurfural (5-HMF) hatten Auswirkungen auf die Verbesserung der Leistungsfähigkeit und den Abbau von oxidativem Stress in der Lungenchirurgie.[2][23]
Herstellung von 2,5-Furandicarbonsäure (FDCA) aus 5-HMF
Die Oxidation von biobasiertem 5-Hydroxymethylfurfural (5HMF) stellt den einfachsten Ansatz zur Erlangung von 2,5-Furandicarbonsäure (FDCA) dar. FDCA wird als einer der wichtigsten biobasierten Bausteine bewertet und wäre ein vollständig nachhaltiger Konkurrent für Terephthalsäure bei Plastikflaschen. Es wäre der Hauptbestandteil von grünen Polymeren wie Polyethylenfuranoat (Polyethylen-2,5-furandicarboxylat) (PEF).
In einem breit angelegten Übersichtsartikel beschreiben Totaro und Kollegen Oxidationsstrategien: Es werden mehrere nachhaltige Ansätze zur Durchführung der Oxidation von biobasiertem 5-Hydroxymethylfurfural (HMF) zu 2,5-Furandicarbonsäure (FDCA) beschrieben. Die neuesten Entwicklungen in der metallvermittelten-heterogenen Katalyse, der metallfreien Katalyse, elektrochemischen Ansätzen, lichtvermittelten Verfahren sowie enzymatischen und biokatalytischen Prozessen werden dargestellt. Die Verfahren haben das Ziel, FDCA unter hoher Ausbeute und milden Bedingungen in nachhaltigen Prozessen zu erreichen.[24]
Avantium hat im Oktober 2024 eine neue Anlage in Betrieb genommen, die FDCA mit einer Kapazität von 5000 Tonnen pro Jahr produzieren wird.[25]
Technische Verwendung
Verwendung in Klebstoffen in der Reifenindustrie
Michelins Tochtergesellschaft „ResiCare“ nutzt 5-HMF für die Produktion umweltfreundlicher Klebstoffe auch in der Reifenproduktion.[17]
Verwendung in Klebstoffen in der Holzindustrie
5-HMF und seine Derivate gelten als wichtige erneuerbare Reaktanten in Klebstoffsystemen als Ersatz des karzinogenen Formaldehyd. Phenol-Formaldehydharze kommen bisher als Bindemittel (Klebstoff) in Holzwerkstoffe wie Spanplatten, OSB-Platten, Sperrholz oder Faserplatten (MDF), HDF in der Bauindustrie und beim Möbelbau sowie im Fahrzeugbau zum Einsatz.[26][27][28][29]
Verwendung für Biopolymere
Durch Oxidation von 5-Hydroxymethylfurfural (5-HMF) aus Fructose wird 2,5-Furandicarbonsäure (FDCA) gewonnen. Die Firma Avantium (Niederlande) eröffnete im Oktober 2024 eine kommerzielle Produktion von FDCA. Die Anlage verfügt über eine Kapazität von 5.000 Tonnen pro Jahr.[30]
FDCA wird dann mit Ethylenglykol weiter zum Biopolymer Polyethylenfuranoat (PEF) polymerisiert.
HMF als Plattformchemikalie
5-Hydroxymethylfuran ist eine Plattformchemikalie. Durch die Struktur von 5-HMF können Reaktionen stattfinden:
- An der Carbonylgruppe
- An der Hydroxygruppe
- Am Furan-Ring
Die Hauptreaktionen sind: Oxidation, Rehydration, Reduktion, Veretherung.
Die wichtigsten 5-HMF Derivate und deren Potentiale können in Anwendungsklassen eingeteilt werden.[31]
| Struktur | Derivat | Summen-formel | CAS-Nummer | Anwendungspotential |
|---|---|---|---|---|
 |
5-Hydroxymethylfurfural (5-HMF) | C6H6O3 | 67-47-0 | Plattformchemikalie |
| 5-Chlorfuran-2-carbonsäure | C5H3ClO | 618-30-4 | Plattformchemikalie | |
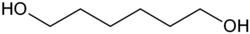
| 1,6-Hexandiol | C6H14O2 | 629-11-8 | Plattformchemikalie | |
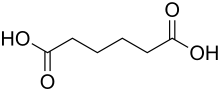 |
Adipinsäure | C6H10O4 | 124-04-9 | Plattformchemikalie |
 |
Lävulinsäure | C5H8O3 | 123-76-2 | Plattformchemikalie |
 |
Ameisensäure | CH2O2 | 64-18-6 | Plattformchemikalie |
| 2,5-Bis(hydroxymethyl)furan (BHMF) | C6H8O3 | 1883-75-6 | Harzvernetzer | |
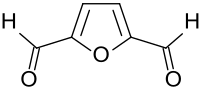 |
2,5-Furandicarbaldehyd (DFF) | C6H4O3 | 823-82-5 | Harzvernetzer |
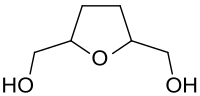 |
Tetrahydrofuran-2,5-dimethanol | C6H12O3 | 104-80-3 | |
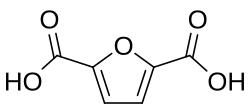 |
2,5-Furandicarbonsäure (FDCA) | C6H4O5 | 3238-40-2 | Biopolymer |
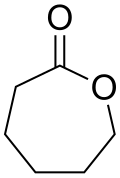 |
Caprolacton | C6H4O5 | 502-44-3 | Biopolymer |
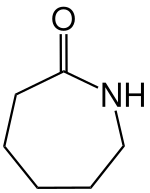 |
Caprolactam | C6H11NO | 105-60-2 | Biopolymer |
 |
Furfurylalkohol | C5H6O2 | 98-00-0 | Lösungsmittel |
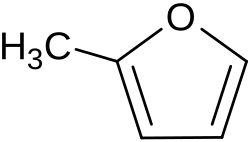 |
2-Methylfuran | C5H6O | 534-22-5 | Lösungsmittel |
-gamma-Valerorolactone_Structural_Formula_V1.svg.png) |
Gamma-Valerolacton | C5H8O2 | 108-29-2 | Lösungsmittel |
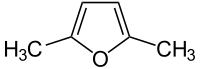 |
2,5-Dimethylfuran (DMF) | C6H8O | 625-86-5 | Diesel-Treibstoffadditiv, Benzinersatz |
| 5-Hydroxymethyl-2-furancarbonsäure | C6H6O4 | 6338-41-6 | Treibstoffadditiv, Benzinersatz | |
| 5-Methylfurfural | C6H6O2 | 620-02-0 | ||
| 5-Formyl-2-furancarbonsäure | C6H4O4 | 13529-17-4 |
HMF basierte Tenside
HMF-basierte Amphiphilie Tenside
Synthese von Hydroxymethylfuran basierten Ethersulfat-Tensiden
HMF-basierte Amphiphilie mit einer hochgradig hydrophilen Einheit und einer hydrophoben Einheit lassen sich gewinnen, indem im ersten Schritt die Hydroxygruppe-Gruppe mit einem Alkohol verethert wird, oder mit einer Fettsäure verestert wird. Im zweiten Schritt wird die Aldehyd-Gruppe des Furan-Ethers mit Natriumhydrogensulfit (NaHSO3) sulfoniert. Die meisten dieser Sulfonate mit kurzkettigem Ether bzw. Säure-Rest weisen eine hohe Löslichkeit in Wasser bei Raumtemperatur auf. Solche „Furan-Ether-Sulfonate“ können als Alternativen zu linearen „Alkylbenzolsulfonaten“ (LAS) betrachtet werden, die die am häufigsten verwendeten Anionischen Tenside sind.
Synthese von Hydroxymethylfuran basierten Natriumsalz-Tensiden
Durch Oxidation der Aldehydgruppe eines Furan-Ethers mit Natriumhydroxid (NaOH) entstehen als dritte Gruppe Natriumsalze. Diese „5-Alkoxymethylfuroinsäure-Natriumsalze“ zeigen eine vergleichbare Oberflächenspannungsminderung wie das kommerzielle Tensid Natriumdodecylbenzolsulfonat (SDBS).
Synthese von Bishydroxymethylfuran-(BHMF) basierten und Bishydroxymethyltetrahydrofuran (BHMTHF) -basierten Ethersulfat-Tensiden.
Ausgehend von HMF wurde seine Aldehydgruppe hydroxiert, sodass ein Furan-Ring bzw. 5er Ring mit zwei Hydroxy-Gruppen vorlag. Bei den Bishydroxymethylfuran- bzw. Bishydroxymethyltetrahydrofuran wurde dann zunächst nur eine selektive Veretherung einer der beiden Hydroxygruppen durchgeführt. Der verbleibende hydrophile Teil wurde dann durch Sulfatierung der zweiten Hydroxygruppen mit dem SO-Py-Komplex und Natriumhydroxyd bereitgestellt. In Bezug auf die Eigenschaften zeigten die von BHMTHF abgeleiteten Tenside mit C12, C14 und C16 Fettketten eine vergleichbare Fähigkeit zur Verringerung der Oberflächenspannung wie die kommerziellen anionischen Tenside lineare LAS und ethoxylat-basierte Fettalkylethersulfate (FAES), wenn auch bei einer niedrigeren Kritische Mizellbildungskonzentration (CMC).[32]
Kationische Tenside auf Basis von HMF
Seitkalieva und Kollegen entwickeln neuartige biobasierte Kationische Tenside, die aus der Plattformchemikalie 5-(Hydroxymethyl)furfural (5-HMF), biobasierten Aminen und Fettsäuren synthetisiert werden. Sie bieten eine nachhaltige Alternative zu herkömmlichen Tensiden. Diese Verbindungen mit Jod als Halogen-Anion, sind oberflächenaktive Ionische Flüssigkeiten. Die als „SAILs“ bezeichneten Verbindungen, haben im Vergleich zu herkömmlichen quartären, kationischen Tensiden mit Ammonium niedrigere Werte für die kritische Mizellbildungskonzentration (CMC).
Die Oberflächeneigenschaften der SAILs werden überwiegend durch die Art der Substitution in der Gruppe der kationischen Köpfe beeinflusst. Morpholin (C4H9NO)- Methyl-Furan Jodid basierte Tenside weisen signifikant niedrigere CMC-Werte auf als Diethyl-Ammonium-Methyl-Furan-Jodid Tenside.
Auf der unpolaren, hydrophoben Seite spielt die Länge der Fettsäure-Alkylkette (n=1, 10, 12, 14, 16, 18) eine wichtige Rolle bei den physikalisch chemischen und biologischen Eigenschaften dieser Tenside, die je nach Kettenlänge variieren. Tenside mit längeren Alkylsubstituenten weisen eine höhere thermische Stabilität und Oberflächenaktivität auf, als kurzkettige Additive. Die Schmelzpunkte der Amin-Jodid Verbindung steigen mit der Kettenlänge der hydrophoben Fettsäuregruppe. Dagegen liegen sie bei den Morpholin-Jodid-Verbindungen-mit 82-99 °C relativ nahe beieinander.
Die neu synthetisierten Amphiphile zeigen eine antimikrobielle Aktivität, die mit bekannten -kationischen, quartären Ammonium Tensiden vergleichbar ist. Weiterhin von Vorteil ist ihre geringere Zytotoxizität.
Diese Verbindungen bleiben in sauren Umgebungen stabil. Sie weisen jedoch unter temperaturgesteuerter Hydrolyse und basischen Bedingungen einen kontrollierten Abbau auf. Ihre Oberflächenaktivität, antimikrobielle Eigenschaften und der kontrollierte Abbau zeigen ihr Potenzial als biobasierte, nachhaltige, wenig toxische Alternativen zu herkömmlichen Tensiden für industrielle und medizinische Anwendungen.[33][34]
Reaktionen mit 5-HMF und anderen Chemikalien
Weigang Fan und Kollegen beschreiben in einem breiten Review, welche mögliche Reaktionen von 5-HMF mit anderen Stoffen zu dessen Derivat-Verbindungen führen.[35]
Weblinks
- Pubchem: 5-hydroxymethylfurfural
- Sicherheitsdatenblatt von Roth, mit anderen Stoffdaten als in der Infobox
- Current Situation of the Challenging Scale‐Up Development of Hydroxymethylfurfural Production - Rosenfeld - 2020 - ChemSusChem - Wiley Online Library 5-Hydroxymethylfurfural (HMF) is a bio-derived platform chemical
- Jie Liang, Jianchun Jiang, Tingting Cai, Chao Liu, Jun Ye, Xianhai Zeng, Kui Wang: Advances in selective conversion of carbohydrates into 5-hydroxymethylfurfural. In: Green Energy & Environment. Band 9, Nr. 9. Science direct, September 2024, S. 1384–1406, doi:10.1016/j.gee.2023.11.005.
Einzelnachweise
- ↑ a b c d e f g h Datenblatt 5-(Hydroxymethyl)-furan-2-carbaldehyd bei Merck, abgerufen am 4. Juli 2025.
- ↑ a b c d e f 5-Hydroxymethylfurfural in der Medizin. In: my-sience.at. Abgerufen am 4. Juli 2025.
- ↑ G. Düll: Über die Einwirkung von Oxalsäure auf Inulin. In: Chemiker-Zeitung. Band 19, Nr. 116, 1895, S. 216–217.
- ↑ Jaroslaw Lewkowski: Synthesis, Chemistry and Applications of 5-Hydroxymethyl-furfural and Its Derivatives. In: ChemInform. 34, 2003, doi:10.1002/chin.200302269.
- ↑ Catherine Billaud, Jean Adrian: Louis‐Camille Maillard, 1878–1936. In: Food Reviews International. Band 19, Nr. 4, S. 345–374, doi:10.1081/fri-120025480.
- ↑ Maillard et al.: Action des acides amines sur les sucres; formation de melanoidines par voie méthodique [Action of amino acids on sugars. Formation of melanoidins in a methodical way]. Comptes Rendus (in French). 154: 66–68.
- ↑ a b DIN 10751-1:2010-08: Untersuchung von Honig – Bestimmung des Gehaltes an Hydroxymethylfurfural – Teil 1: Photometrisches Verfahren nach Winkler.
- ↑ a b 5-HMF-Gehalte in Lebensmitteln sind nach derzeitigem wissenschaftlichen Kenntnisstand gesundheitlich unproblematisch. (PDF) In: bfr.bund.de. BfR, 15. Mai 2011, abgerufen am 30. Oktober 2019.
- ↑ What role does 5-Hydroxymethylfurfural (HMF) play in the food industry, particularly in the context of flavoring and preservation? In: sugar-energy.com. 3. März 2025, abgerufen am 3. Juli 2025 (englisch).
- ↑ Ben-Erik van Wyck: Food Plants of the World Timber Press, 2006, ISBN 0-88192-743-0. S. 134.
- ↑ a b c Mahmoud Sayed, Niklas Warlin, Christian Hulteberg, Ian Munslow, Stefan Lundmark, Oleg Pajalic, Per Tunå, Baozhong Zhang, Sang-Hyun Pyo, Rajni Hatti-Kaul: 5-Hydroxymethylfurfural from fructose: an efficient continuous process in a water-dimethyl carbonate biphasic system with high yield product recovery. In: Green Chem. Band 22, 20. Juli 2020, S. 5402–5413, doi:10.1039/D0GC01422B.
- ↑ Y. Su, H. M. Brown, X. Huang, X. Zhou, J. E. Amonette, Z. C. Zhang: Single-step conversion of cellulose to 5-hydroxymethylfurfural (HMF), a versatile platform chemical. In: Applied Catalysis A; General. Band 361, Nr. 1-2, 20. Juni 2009, S. 117–122, doi:10.1016/j.apcata.2009.04.002.
- ↑ Jozinović A, Šarkanj B, Ačkar Đ, Panak Balentić J, Šubarić D, Cvetković T, Ranilović J, Guberac S, Babić J: Simultaneous Determination of Acrylamide and Hydroxymethylfurfural in Extruded Products by LC-MS/MS Method., Molecules. 2019 May 22;24(10):1971, PMID 31121914.
- ↑ Hu Y, Liu X, Wu X, Zhang Z, Wu D, Chen C, Su W, Zhang L, Li J, Wang HD.: Several natural phytochemicals from Chinese traditional fermented food-pickled Raphanus sativus L.: Purification and characterization., Food Chem X. 2022 Jul 16;15:100390, PMID 35874426.
- ↑ AVALON Industries übernimmt alle biobasierten Chemieaktivitäten von AVA-CO2 - Renewable Carbon News. In: renewable-carbon.eu. Abgerufen am 6. Juli 2025.
- ↑ AVA Biochem AG - Zug, Schweiz. In: bionity.com. Abgerufen am 6. Juli 2025.
- ↑ a b Michelin baut 5-HMF-Fabrik: Süßer Stoff für grüne Chemie. In: autoservicepraxis.de. 26. Mai 2025, abgerufen am 4. Juni 2025.
- ↑ Angel Gusto: Cerisea – Produzieren Sie ein biobasiertes Hochleistungs-Zwischenprodukt für die nachhaltige Industrie! In: cerisea-project.eu. Abgerufen am 4. Juli 2025.
- ↑ 5-Hydroxymethylfurfural, CAS No. 67-47-0. In: carlroth.com. Carl Roth, abgerufen am 4. Juli 2025.
- ↑ Blomqvist et al.: Glutamine and α-Ketoglutarate Prevent the Decrease in Muscle Free Glutamine Concentration and Influence Protein Synthesis after Total Hip Replacement, Metabolism, Vol 44, No 9 (September), 1995: S. 1215–1222.
- ↑ Heidelinde Pfliger: Etablierung und Messung der direkten und indirekten antioxidativen Wirkungen von AKG, 5HMF und Vitamin C in Gegenwart von Peroxonitrat, MTUniversity Graz, Diplomarbeit 2009, 99 Bl, Signatur: II 723159 (unipub.uni-graz.at PDF).
- ↑ Wagner et al.: The potential antimutagenic and antioxidant effects of Maillard reaction products used as “natural antibrowning” agents. Mol Nutr Food Res., 2007 Apr.; 51(4): 496–50.
- ↑ Veronika Matzi, Joerg Lindenmann, Andreas Muench, Joachim Greilberger, Heinz Juan, Reinhard Wintersteiger, Alfred Maier, Freyja Maria Smolle-Juettner: The impact of preoperative micronutrient supplementation in lung surgery. A prospective randomized trial of oral supplementation of combined alpha-ketoglutaric acid and 5-hydroxymethylfurfural. In: Pubmed (Hrsg.): Eur J Cardiothorac Surg. Band 5, November 2007, S. 776–782, doi:10.1016/j.ejcts.2007.07.016, PMID 17768058.
- ↑ Grazia Totaro, Laura Sisti, Paola Marchese, Martino Colonna, Angela Romano, Claudio Gioia, Micaela Vannini, Annamaria Celli: Current Advances in the Sustainable Conversion of 5‐Hydroxymethylfurfural into 2,5‐Furandicarboxylic Acid. In: Green Conversion of HMF e202200501. Band 15, Nr. 13, 7. Juli 2022, doi:10.1002/cssc.202200501.
- ↑ Siu-Ha Soo-Tang, Anke Schwarzenberger: Avantium Celebrates the Official Opening of its FDCA Flagship Plant. In: peference.eu. 22. Oktober 2024, abgerufen am 4. Juli 2025 (englisch).
- ↑ Karzinogenes Formaldehyd durch biobasiertes, nicht-toxisches 5-HMF ersetzen - AVALON Industries gewinnt neues Schweizer Forschungsprojekt. In: chemie.de. 31. Januar 2017, abgerufen am 4. Juni 2025.
- ↑ Thoma C, Konnerth J, Sailer-Kronlachner W, Rosenau T, Potthast A, Solt P, van Herwijnen HWG: Hydroxymethylfurfural and its Derivatives: Potential Key Reactants in Adhesives., ChemSusChem. 2020 Oct 21;13(20):5408-5422, PMID 32755049.
- ↑ Thoma C, Solt P, Sailer-Kronlachner W, Rosenau T, Potthast A, Konnerth J, Pellis A, van Herwijnen HWG: Dataset for chemorheological and rheokinetic analysis of carbohydrate-HMF-amine adhesives. Data Brief. 2021 Oct 9;39:107465, PMID 34703856.
- ↑ Steven Eschig: AdLigno – Formaldehydfreie Bio-Klebstoffe aus Lignin, Zuckerderivaten und Huminen für die Holzwerkstoffherstellung - Fraunhofer WKI. Fraunhofer-Institut für Holzforschung, Wilhelm-Klauditz-Institut WKI, 1. Juli 2020, abgerufen am 4. Juni 2025.
- ↑ Caroline van Reedt Dortland: Avantium Celebrates the Official Opening of its FDCA Flagship Plant. Avantium, 22. Oktober 2024, abgerufen am 4. Juni 2025 (englisch).
- ↑ Catherine Rosenfeld, Johannes Konnerth, Wilfried Sailer-Kronlachner, Pia Solt, Thomas Rosenau, Hendrikus W. G. van Herwijnen: Current Situation of the Challenging Scale-Up Development of Hydroxymethylfurfural Production. In: ChemSusChem. Band 13, Nr. 14, 17. April 2020, S. 3544–3564, doi:10.1002/cssc.202000581.
- ↑ Xiaoyang Yue, Yves Queneau: 5-Hydroxymethylfurfural and Furfural Chemistry Toward Biobased Surfactants. In: ChemSusChem (Hrsg.): Green Conversion of HMF. Band 15, Nr. 13, 7. Juli 2022, 202102660, doi:10.1002/cssc.202102660.
- ↑ Marina M Seitkalieva, Anna V Vavina, Elena N Strukova, Aida I Samigullina, Maxim R Sokolov, Maria A Kalinina, Valentine P Ananikov: Bio-Based Cationic Surfactants from 5-(Hydroxymethyl)furfural for Antimicrobial Applications: The Role of Cationic Substitutes, Alkyl Chains, and Ester Linkages. In: ChemSusChem. Band 18, Nr. 11, 6. Februar 2025, 202402586, doi:10.1002/cssc.202402586.
- ↑ Marina M Seitkalieva, Anna V Vavina, Elena N Strukova, Aida I Samigullina, Maxim R Sokolov, Maria A Kalinina, Valentine P Ananikov: Supplement zu Bio-Based Cationic Surfactants from 5-(Hydroxymethyl)furfural for Antimicrobial Applications: The Role of Cationic Substitutes, Alkyl Chains, and Ester Linkages. In: ChemSusChem. Band 18, Nr. 11, 6. Februar 2025, 202402586, doi:10.1002/cssc.202402586 (wiley.com [PDF]).
- ↑ Weigang Fan, Charlie Verrier, Yves Queneau, Florence Popowycz: 5-Hydroxymethylfurfural (HMF) in Organic Synthesis: A Review of its Recent Applications Towards Fine Chemicals. (PDF) In: udl.hal.science. Université Lyon 1, INSA Lyon, 2019, S. 583-614, abgerufen am 4. Juni 2025 (englisch).

furan.svg.png)