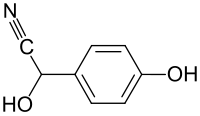
4-Hydroxymandelonitril
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 4-Hydroxymandelonitril | ||||||||||||
| Summenformel | C8H7NO2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 149,15 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
98 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
4-Hydroxymandelonitril ist eine organische Verbindung aus der Gruppe der Cyanhydrine, der als Naturstoff vorkommt.
Isomere
Von 4-Hydroxymandelonitril existieren zwei spiegelbildliche Isomere: (S)-4-Hydroxymandelonitril und (R)-4-Hydroxymandelonitril.
| Isomere von 4-Hydroxymandelonitril | ||
| Name | (S)-4-Hydroxymandelonitril | (R)-4-Hydroxymandelonitril |
| Strukturformel | -4-Hydroxymandelonitrile_Structural_Formula_V1.svg.png)
|
-4-Hydroxymandelonitrile_Structural_Formula_V1.svg.png)
|
| CAS-Nummer | 71807-09-5 | 77943-99-8 |
| 13093-65-7 (unspezifiziert) | ||
| EG-Nummer | – | 632-848-8 |
| – (unspezifiziert) | ||
| ECHA-Infocard | – | 100.160.971 |
| – (unspezifiziert) | ||
| PubChem | 440104 | 14293614 |
| 166768 (unspezifiziert) | ||
| Drugbank | DB03430 | – |
| – | ||
| Wikidata | Q27094357 | Q131767318 |
| Q27102830 (unspezifiziert) | ||
Vorkommen

Beide Enantiomere kommen natürlich als Aglycon in cyanogenen Glycosiden vor. Taxiphyllin ist das Glucosid von (R)-4-Hydroxymandelonitril, Dhurrin das Glucosid von (S)-4-Hydroxymandelonitril.[2] Dhurrin kommt beispielsweise in allen Teilen der Pflanze Suckleya suckleyana (Familie Fuchsschwanzgewächse) vor,[3] außerdem in der Sorghumhirse, während Taxiphyllin beispielsweise im Strand-Dreizack vorkommt.[2]
Biosynthese
Die Biosynthese verläuft vermutlich ausgehend von Tyrosin über 4-Hydroxyphenylacetaldoxim[S 1] und 4-Hydroxyphenylacetonitril zu Hydroxymandelonitril, welches leicht zu 4-Hydroxybenzaldehyd und Cyanwasserstoff zerfällt, in Gegenwart von UDP-Glucose und einer Glucosyltransferase aber zu Dhurrin oder Taxiphyllin glucosyliert wird.[2]
Herstellung
Racemisches 4-Hydroxymandelonitril kann durch Reaktion von 4-Hydroxybenzaldehyd mit Cyanwasserstoff in tert-Butylmethylether in Gegenwart eines schwach basischen Ionentauschers hergestellt werden. Die enzymatische enantioselektive Synthese von (R)-4-Hydroxymandelonitril ist in einem zweiphasigen System (Pufferlösung pH 5,5 / tert-Butylmethylether) möglich. Dabei wird das Edukt 4-Hydroxybenzaldehyd im organischen Lösungsmittel gelöst, das Enzym Hydroxynitrillyase aus Prunus amygdalis (Mandelbaum) im Puffer, und Cyanwasserstoff zugegeben.[4]
Einzelnachweise
- ↑ a b c d DL-4-Hydroxymandelonitrile – CAS 13093-65-7 – SCBT - Santa Cruz Biotechnology. In: scbt.com. Abgerufen am 17. Januar 2025 (englisch).
- ↑ a b c Wolfgang Hösel, Adolf Nahrstedt: In vitro biosynthesis of the cyanogenic glucoside taxiphyllin in Triglochin maritima. In: Archives of Biochemistry and Biophysics. Band 203, Nr. 2, September 1980, S. 753–757, doi:10.1016/0003-9861(80)90235-0.
- ↑ Adolf Nahrstedt, Matthias Lechtenberg, Anita Brinker, David S. Seigler, Robert Hegnauer: 4-Hydroxymandelonitrile glucosides, dhurrin in Suckleya suckleyana and taxiphyllin in Girgensohnia oppositiflora (Chenopodiaceae). In: Phytochemistry. Band 33, Nr. 4, Juli 1993, S. 847–850, doi:10.1016/0031-9422(93)85288-3.
- ↑ W. F. Willeman, R. Neuhofer, I. Wirth, P. Pöchlauer, A. J. J. Straathof, J. J. Heijnen: Development of (R)‐4‐hydroxymandelonitrile synthesis in an aqueous–organic biphasic stirred tank batch reactor. In: Biotechnology and Bioengineering. Band 79, Nr. 2, 20. Juli 2002, S. 154–164, doi:10.1002/bit.10317.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Hydroxyphenylacetaldoxim: CAS-Nr.: 23745-82-6, PubChem: 152653, ChemSpider: 134545, Wikidata: Q27098176.
