Xanthoprotein-Reaktion

Die Xanthoprotein-Reaktion (griech.: xanthos „gelb“, proteuo „erster“) ist eine Nachweisreaktion für aromatische Aminosäuren in Proteinen.[1] Zu den reaktiven Aminosäuren gehören Tyrosin und Tryptophan.
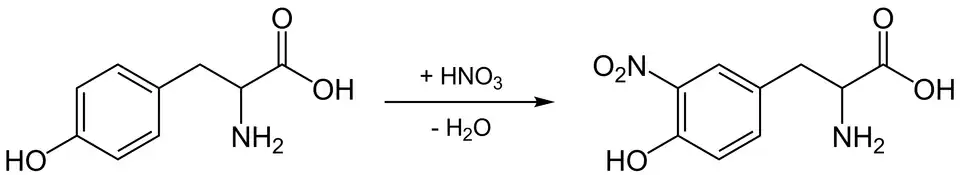
Bei der Zugabe von Salpetersäure (HNO3) findet eine Nitrierung am Benzolring statt.
Gibt man die Salpetersäure zu Eiklar, findet eine Ausflockung statt, die auf die Denaturierung des Eiklars durch die Säure zurückzuführen ist. Erhitzt man diese Lösung zusätzlich, entsteht eine gelbe Nitroverbindung. Dabei wird ein Wasserstoffatom durch die NO2-Gruppe (aus der Salpetersäure) substituiert. Analog verfärbt sich die Haut beim Kontakt mit konzentrierter Salpetersäure gelblich, da Hautzellen ebenfalls Proteine mit aromatischen Aminosäuren enthalten. Bei Zugabe einer Base, wie z. B. Ammoniaklösung (NH4OH), wird die Farbe orange. Diese Farbveränderungen werden durch nitrierte aromatische Ringe im Protein verursacht. Der Xanthoproteintest ist spezifisch für aromatische Verbindungen wie Tyrosin, Tryptophan und Phenylalanin.
Weitere Nachweisreaktionen für Proteine
Einzelnachweise
- ↑ Beyer-Walter: Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998, ISBN 3-7776-0808-4.