Trimethadion
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
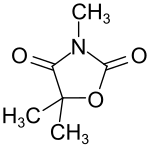
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Trimethadion[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H9NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N03AC02 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 143,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
78–80 °C (6,6 hPa)[3] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Trimethadion ist eine chemische Verbindung aus der Gruppe der Oxazolidinone.
Gewinnung und Darstellung
Trimethadion kann durch Reaktion von 5,5-Dimethyloxazolidin-2,4-dion[S 1] und Natriumhydroxid in Wasser mit Dimethylsulfat hergestellt werden. Die Verbindung wurde 1944 zum ersten Mal von M. A. Spielman synthetisiert und 1951 von Abbot und British Scheering patentiert.[4][5][6][7]
Eigenschaften
Trimethadion ist ein weißes bis gelbliches, kristalles Pulver, das löslich in Wasser ist.[2] In reinem Zustand hat es einen brennenden, leicht scharfen Geschmack und einen milden Camphergeruch.[6]
Verwendung
Trimethadion wird als Antikonvulsivum verwendet.[5] Es ist angezeigt zur Behandlung von Petit-Mal-Anfällen, die auf die Behandlung mit anderen Arzneimitteln nicht ansprechen.[8] Trimethadion-Präparate wurden in den USA (Handelsname Tridione) und in europäischen Ländern vom Markt genommen aufgrund der selten gewordenen Verwendung sowie möglicher schwerer Nebenwirkungen (Stevens-Johnson-Syndrom, hämatologische Komplikationen[8]) und Teratogenität (vgl. Trimethadion-Embryopathie).[9][10]
Regulierung
Über den Safe Drinking Water and Toxic Enforcement Act of 1986 besteht in Kalifornien seit dem 1. Januar 1991 eine Kennzeichnungspflicht für Produkte, die Trimethadion enthalten.[11]
Einzelnachweise
- ↑ INN Recommended List 1. In: who.int. Mai 1955, abgerufen am 29. April 2025 (englisch).
- ↑ a b c d e f g Eintrag zu Trimethadione, >98.0% bei TCI Europe, abgerufen am 28. April 2025.
- ↑ Eckard Amelingmeier, Michael Berger, Uwe Bergsträßer, Helmut Blome, Alfred Blume: RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999. Thieme, 2014, ISBN 978-3-13-200071-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics. CRC Press, 2011, ISBN 978-1-4398-5512-6, S. 3–536 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Charles E. Wells: Trimethadione: Its Dosage and Toxicity. In: A.M.A. Archives of Neurology & Psychiatry. Band 77, Nr. 2, 1957, S. 140–155, doi:10.1001/archneurpsyc.1957.02330320038005.
- ↑ a b M. A. Spielman: Some Analgesic Agents Derived from Oxazolidine-2,4-dione. In: Journal of the American Chemical Society. Band 66, Nr. 8, 1944, S. 1244–1245, doi:10.1021/ja01236a005.
- ↑ Ashutosh Kar: Medicinal Chemistry. New Age International (P) Limited, 2005, ISBN 978-81-224-1565-0, S. 153 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Tridione Label (PDF-Datei) auf accessdata.fda.gov, Stand Juni 2012.
- ↑ Douglas Petkus: The discontinuation of Tridione. In: The American Journal of Medicine. 1995, Band 99, Nummer 3, S. 333. DOI:10.1016/s0002-9343(99)80176-4.
- ↑ Orphanet: Fetal trimethadione syndrome. In: orpha.net. Abgerufen am 29. April 2025 (englisch).
- ↑ Trimethadione. OEHHA, 1. Januar 1991, abgerufen am 28. April 2025 (englisch).