Triflatgruppe
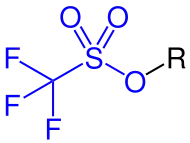

Als Triflatgruppe (CF3SO3−) wird der kovalent gebundene Rest der Trifluormethansulfonsäure bezeichnet. Es handelt sich dabei um die Ester oder Salze der Trifluormethansulfonsäure. Ihr Name leitet sich von ihrer systematischen Bezeichnung Trifluormethansulfonat ab. Die Verbindungen werden gewöhnlich als Triflate bezeichnet. In Strukturformeln wird die Triflatgruppe oft mit OTf abgekürzt und ähnelt der Mesylatgruppe.
Die Triflatgruppe enthält die Triflylgruppe, die ein Sauerstoffatom weniger aufweist, vollständig. Insofern wird auch seltener von der Triflyloxygruppe gesprochen (als Kontraktion von Trifluormethansulfonyloxy-).[1][2]
Herstellung
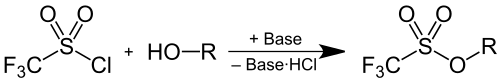
Triflate können durch Deprotonierung eines Alkohols und anschließender Reaktion mit Trifluormethansulfonylchlorid hergestellt werden, wobei ein Äquivalent Chlorwasserstoff durch eine Base als Hydrochlorid gebunden wird:
Eigenschaften
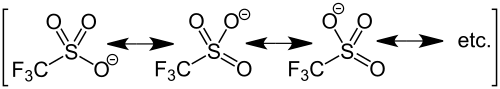
Durch die negativen induktiven Effekte der Fluoratome sind das Schwefel- sowie die Sauerstoffatome sehr elektronenarm. Zusätzlich ist das Triflation über drei Grenzstrukturen gut mesomeriestabilisiert. Dies führt dazu, dass die Trifluormethansulfonsäure eine starke Säure und somit das Triflation eine schwache Base ist, welche durch geeignete Nukleophile leicht unter Substitution abgespalten werden kann. Aus diesem Grund müssen Triflatverbindungen in Abwesenheit von Nukleophilen, beispielsweise Wasser oder Alkohole, aufbewahrt werden.
Verwendung
Die Triflatgruppe ist eine ausgezeichnete Abgangsgruppe und findet als solche Anwendung in der präparativen Organischen Chemie. Durch Überführung von Alkoholen in Triflate wird die schlechte Abgangsgruppe OH− in eine gute Abgangsgruppe (CF3SO3−) überführt, wodurch Substitutionsreaktionen an dieser Position ermöglicht werden. Triflate sind hierbei bis zu 10.000 mal reaktiver als Tosylate.[3]
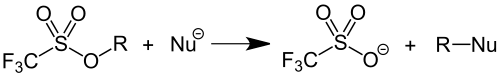
Diese Anwendung ist nicht besonders atomökonomisch, da stets stöchiometrische Mengen von Abfallstoffen mit vergleichsweise hoher Molekularmasse gebildet werden. Deshalb wird die Synthesemethode vorwiegend im Labormaßstab und kaum in technischen Prozessen eingesetzt.
Mit Alkoholen bilden Alkyltriflate Ether im Sinne einer Williamsonschen Ethersynthese.[4]
In Palladium-katalysierten Reaktionen wie der Suzuki- oder Sonogashira-Kupplung können Aryl- oder Alkenyltriflate anstelle der häufig eingesetzten Halogenverbindungen eingesetzt werden. Die Reihe der Reaktivität der Arylverbindungen ist hierbei:[5]
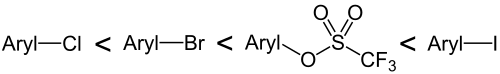
11C-markiertes Methyltriflat wird zur Einführung markierter Methylgruppen in biologischen Molekülen verwendet.[4]
Siehe auch
Verbindungen mit einer Triflatgruppe werden in der Kategorie:Trifluormethansulfonat aufgeführt.
Weblinks
Einzelnachweise
- ↑ Keisuke Uchida, Suguru Yoshida, Takamitsu Hosoya: Three-Component Coupling of Triflyloxy-Substituted Benzocyclobutenones, Organolithium Reagents, and Arynophiles Promoted by Generation of Aryne via Carbon–Carbon Bond Cleavage. In: Organic Letters. Band 19, Nr. 5, 3. März 2017, S. 1184–1187, doi:10.1021/acs.orglett.7b00242.
- ↑ Xueru Zhangy, Shuanhu Gao: Hydroxy(triflyloxy)copper(II) Bis(N-methylimidazole) Complex. In: Encyclopedia of Reagents for Organic Synthesis. Wiley, 25. April 2022, S. 1, doi:10.1002/047084289x.rn02469.
- ↑ Autorenkollektiv, Organikum, 21. Auflage, Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8, S. 217.
- ↑ a b Eintrag zu Trifluormethansulfonsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ Autorenkollektiv, Organikum, 21. Auflage, Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8, S. 405–407.