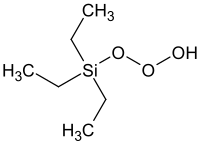
Triethylsilylhydrotrioxid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Triethylsilylhydrotrioxid | |||||||||
| Summenformel | C6H16O3Si | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 164,27 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Triethylsilylhydrotrioxid ist eine organische Verbindung, konkret eine Organosiliciumverbindung und ein Hydrotrioxid.
Herstellung
Triethylsilylhydrotrioxid kann durch Reaktion von Triethylsilan mit Ozon in Dichlormethan bei −78 °C hergestellt werden. Wegen der geringen Stabilität wird die Verbindung in situ hergestellt und dann sofort eingesetzt.[2]
Eigenschaften und Reaktionen
Bei −78 °C in Dichlormethan zerfällt Triethylsilylhydrotrioxid mit einer Halbwertszeit von etwa 150 Sekunden unter Freisetzung von Singulett-Sauerstoff zu Triethylsilanol. Dadurch ermöglicht es einige für Singulett-Sauerstoff typische Reaktionen wie die Bildung von Endoperoxiden, beispielsweise die Oxidation von α-Terpinen zu Ascaridol, sowie die Bildung von Endoperoxiden von 1,3-Cyclohexadien und 9,10-Dimethylanthracen.[3] Neben der Bildung von Singulett-Sauerstoff kann Triethylsilylhydrotrioxid direkt mit Alkenen reagieren und diese zu Carbonylverbindungen spalten. Beispielsweise wird 2-Phenyl-1-hexen zu Butylphenylketon umgesetzt. Mit elektronenreichen Alkenen kann es stattdessen unter Bildung eines 1,2-Dioxetans reagieren, das in manchen Fällen isoliert werden kann.[2]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Gary H. Posner, Kevin S. Webb, William M. Nelson, Takashi Kishimoto, Howard H. Seliger: A new oxidizing reagent: triethylsilyl hydrotrioxide. In: The Journal of Organic Chemistry. Band 54, Nr. 14, Juli 1989, S. 3252–3254, doi:10.1021/jo00275a003.
- ↑ E. J. Corey, Mukund M. Mehrotra, Ahsan U. Khan: Generation of 1.DELTA.g oxygen from triethylsilane and ozone. In: Journal of the American Chemical Society. Band 108, Nr. 9, April 1986, S. 2472–2473, doi:10.1021/ja00269a070.