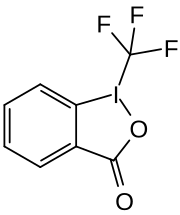
1-(Trifluormethyl)-1,2-benziodoxol-3(1H)-on
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1-(Trifluormethyl)-1,2-benziodoxol-3(1H)-on | ||||||||||||||||||
| Andere Namen |
Togni-Reagenz II | ||||||||||||||||||
| Summenformel | C8H4F3IO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 316,02 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Methylenchlorid, Chloroform, Acetonitril, Methanol, Ethanol, Aceton[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
1-(Trifluormethyl)-1,2-benziodoxol-3(1H)-on (Togni-Reagenz II) ist eine bei Raumtemperatur stabile Verbindung, die in der organischen Synthese zur direkten elektrophilen Trifluormethylierung verwendet wird. Es kann Trifluormethylgruppen (CF3) beispielsweise auf Alkohole oder terminale Alkene übertragen.
Geschichte
Eine erste Beschreibung von Herstellung, Eigenschaften und Reaktivität der Verbindung erfolgte 2006 durch Antonio Togni und seine Mitarbeiter von der ETH Zürich.[3] Der Artikel enthält auch Informationen zu 1,3-Dihydro-3,3-dimethyl-1-(trifluormethyl)-1,2-benziodoxol (Togni-Reagenz I).[S 1]
Gewinnung und Darstellung
Die Synthese erfolgt in einem dreistufigen Verfahren. Im ersten Schritt wird 2-Iodbenzoesäure in Gegenwart von Natriumperiodat eine Oxidation und Cyclisierung zum gemischten Anhydrid 1-Hydroxy-1,2-benziodoxol-3(1H)-on[S 2] umgesetzt. Durch Acylierung mit Acetanhydrid und anschließende Substitution mit Trimethyl(trifluormethyl)silan entsteht die Zielverbindung.[1]
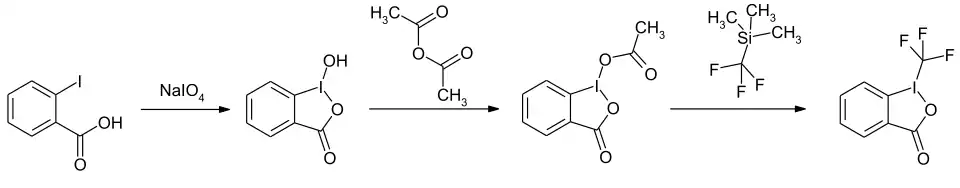
Eine neuere Eintopfsynthese geht ebenfalls von der 2-Iodbenzoesäure aus. Als Oxidationsmittel wird statt Natriumperiodat Trichlorisocyanursäure verwendet.[4]
Eigenschaften
Physikalische Eigenschaften
Die Verbindung kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) mit den Gitterparametern a = 8,6543 Å; b = 8,2276 Å, c = 12,4646 Å und β = 90,829 ° sowie 4 Formeleinheiten pro Elementarzelle. Aus den kristallographischen Daten wurde eine Dichte von 2,365 g·cm−3 abgeleitet.[3]
Chemische Eigenschaften
Die reine Verbindung ist bei Raumtemperatur über Monate thermisch stabil. Oberhalb des Schmelzpunktes erfolgt eine heftige Zersetzung, wobei gasförmiges Trifluoriodmethan freigesetzt wird.[1] Die Zersetzung verläuft stark exotherm. In einer DSC-Messung wurde ab 149 °C eine Zersetzungswärme von −502 J·g−1 bzw. −158,6 kJ·mol−1 bestimmt.[5] Als Zersetzungsprodukte bei einer Rekristallisation aus Acetonitril wurden in geringer Menge Trifluormethyl-2-iodbenzoat[S 3] und 2-Iodbenzoylfluorid[S 4] beobachtet.[1] Die Prüfungen hinsichtlich explosionsgefährlicher Eigenschaften sind für den Stahlhülsentest und die Schlagempfindlichkeit positiv[5], für die Reibempfindlichkeit negativ.[6] Es handelt sich somit um einen explosionsgefährlichen Stoff. Die Verbindung reagiert heftig mit starken Basen und Säuren sowie Reduktionsmitteln.[1] Im Lösungsmittel Tetrahydrofuran wird dessen Polymerisation initiiert.[1]
Verwendung
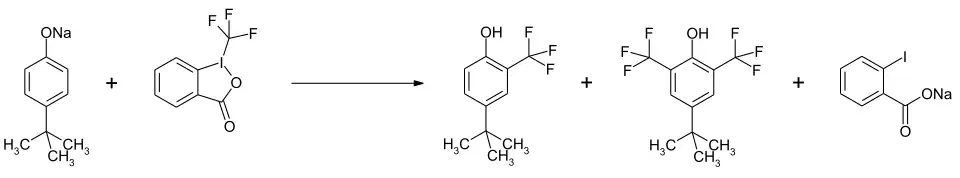
Die Verbindung wird in der Trifluormethylierung zur Einführung der CF3-Gruppe in organische Verbindungen genutzt, wobei es als Elektrophil wirkt, das mit Nucleophilen reagiert.[7] Bei Phenolaten erfolgt eine Substitution in ortho-Stellung. Mit einem Überschuss kann eine zweifache Substitution erreicht werden.[8]
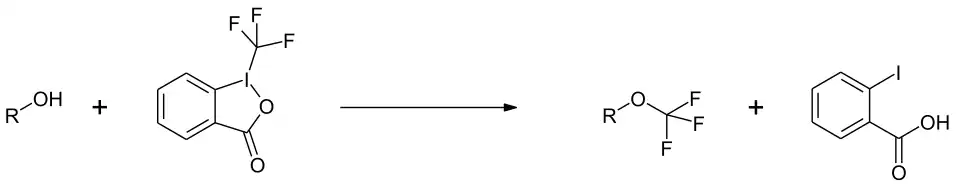
Mit Alkoholen ergeben sich die entsprechenden Trifluormethylether.[9]
Eine Addition der CF3-Funktion kann unter Kupferkatalyse an terminale Olefine erfolgen.[10]

Einzelnachweise
- ↑ a b c d e f g h Kyrill Stanek, Raffael Koller, Iris Kieltsch, Patrick Eisenberger, Antonio Togni: 1-(Trifluoromethyl)-1,2-benziodoxol-3(1H)-one. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2001, ISBN 0-470-84289-X, doi:10.1002/047084289X.rn01121.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1-Trifluoromethyl-1,2-benziodoxol-3(1H)-one (contains 60 % Diatomaceous earth) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Oktober 2020.
- ↑ a b Patrick Eisenberger, Sebastian Gischig, Antonio Togni: Novel 10-I-3 Hypervalent Iodine-Based Compounds for Electrophilic Trifluoromethylation. In: Chemistry – A European Journal. Band 12, Nr. 9, 2006, S. 2579–2586, doi:10.1002/chem.200501052.
- ↑ Václav Matoušek, Ewa Pietrasiak, Rino Schwenk, Antonio Togni: One-Pot Synthesis of Hypervalent Iodine Reagents for Electrophilic Trifluoromethylation. In: The Journal of Organic Chemistry. Band 78, Nr. 13, Juni 2013, S. 6763–6768, doi:10.1021/jo400774u.
- ↑ a b Nikolaus Fiederling, Jan Haller, Heiko Schramm: Notification about the Explosive Properties of Togni’s Reagent II and One of Its Precursors. In: Organic Process Research & Development. Band 17, Nr. 3, März 2013, S. 318–319, doi:10.1021/op400035b.
- ↑ Devoille, A.; Haller, J.: Facing the unknown with confidence: working with unidentified hazardous properties of chemical reagents. In: Chemistry Today 32(3) May/June 2014, 47–50.
- ↑ I. Kieltsch, P. Eisenberger, K. Stanek, A. Togni: Recent Advances in Electrophilic CF3-Transfer Using Hypervalent Iodine(III) Reagents. In: Chimia. 62, 2008, S. 260–263, doi:10.2533/chimia.2008.260.
- ↑ Kyrill Stanek, Raffael Koller, Antonio Togni: Reactivity of a 10-I-3 Hypervalent Iodine Trifluoromethylation Reagent With Phenols. In: The Journal of Organic Chemistry. Band 73, Nr. 19, September 2008, S. 7678–7685, doi:10.1021/jo8014825.
- ↑ Raffael Koller, Kyrill Stanek, Daniel Stolz, Raphael Aardoom, Katrin Niedermann, Antonio Togni: Zinc-Mediated Formation of Trifluoromethyl Ethers from Alcohols and Hypervalent Iodine Trifluoromethylation Reagents. In: Angewandte Chemie. Band 121, Nr. 24, 2009, S. 4396–4400, doi:10.1002/ange.200900974.
- ↑ Andrew T. Parsons, Stephen L. Buchwald: Copper-Catalyzed Trifluoromethylation of Unactivated Olefins. In: Angewandte Chemie. Band 123, Nr. 39, 2011, S. 9286–9289, doi:10.1002/ange.201104053.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,3-Dihydro-3,3-dimethyl-1-(trifluormethyl)-1,2-benziodoxol: CAS-Nr.: 887144-97-0, EG-Nr.: 626-754-6, ECHA-InfoCard: 100.155.124, PubChem: 16043572, ChemSpider: 13172111, Wikidata: Q27257820.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1-Hydroxy-1,2-benziodoxol-3(1H)-on: CAS-Nr.: 131-62-4, PubChem: 67231, ChemSpider: 60566, Wikidata: Q27123562.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Trifluormethyl-2-iodbenzoat: CAS-Nr.: 1174287-22-9, PubChem: 45142162, Wikidata: Q131327731.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Iodbenzoylfluorid: CAS-Nr.: 1064679-44-2, PubChem: 162401775, ChemSpider: 26591899, Wikidata: Q131327736.
