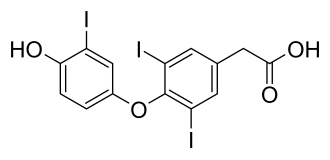
Tiratricol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tiratricol[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C14H9I3O4 | |||||||||||||||||||||
| Kurzbeschreibung |
Weißes bis off-weißes nicht hygroskopisches Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Schilddrüsenhormon-Analoga | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 621,93 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
Fest[2] | |||||||||||||||||||||
| Löslichkeit |
Schwer löslich in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Tiratricol ist ein natürlicher Metabolit des Schilddrüsenhormons Triiodthyronin (T3), welches für den Energiestoffwechsel und das Zellwachstum bedeutsam ist. Tiratricol hat eine mit T3 vergleichbare Wirkung, unterscheidet sich jedoch im Transmembrantransport und leicht in der Rezeptorspezifität. Es wird als Arzneistoff verwendet.
Eigenschaften

Tiratricol ist chemisch-strukturell eng mit Triiodthyronin (T3) und Thyroxin (T4) verwandt, hat aber kein Stereozentrum und ist nicht optisch aktiv.
Pharmakologisch unterscheidet es sich vom T3 in den Affinitäten zu den Schilddrüsenhormon-Rezeptoren, im Transmembrantransport und in den pharmakokinetischen Eigenschaften.[4] Es zirkuliert in sehr viel geringeren Konzentrationen als T3 im menschlichen Körper. Der genaue Mechanismus der Biosynthese ist nicht geklärt;[4] einer gängigen Hypothese zufolge entsteht Tiratricol hauptsächlich in der Leber durch Seitenkettenmodifikation von T3.[2]
Therapeutische Verwendung
Aufgrund der thyreomimetischen Eigenschaften von Tiratricol wurde seine Verwendung bei der Behandlung verschiedener Schilddrüsenerkrankungen erforscht.[4]
Thyreotoxikose
Unter dem Namen Emcitate (Hersteller: SpringWorks Therapeutics) wurde Tiratricol im Februar 2025 EU-weit zugelassen zur oralen Behandlung der peripheren Thyreotoxikose bei Patienten mit dem Allan-Herndon-Dudley-Syndrom.[5] Diese selten vorkommende Form krankhaft erhöhte Blutspiegel bestimmter Schilddrüsenhormone entsteht durch einen erblich bedingten Mangel an Monocarboxylat-Transporter-8 (MCT8). Das Protein MCT8 transportiert Schilddrüsenhormon durch die Zellmembran in das Zellinnere. Im Gegensatz zu T3 und T4 kann Tiratricol ohne einen funktionierenden MCT8 in die von MCT8 abhängigen Zellen eindringen und in MCT8-abhängigem Gewebe die normale Schilddrüsenhormonaktivität wieder herstellen.[6]
Für diese Indikation erhielt Tiratricol 2017 den Status als Orphan-Arzneimittel.[7] Die Zulassung beruht auf den Ergebnissen einer einarmigen, offenen, multizentrischen Studie mit 46 Patienten (Triac-Studie I).[2][8]
Die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Gabe von Tiratricol waren Hyperhidrose, Durchfall, Reizbarkeit, Angstzustände und Albträume. Sie traten in der Regel bei Behandlungsbeginn und Dosiserhöhung auf und klangen innerhalb weniger Tage ab. Es kann zu Wechselwirkungen kommen mit anderen Arzneimitteln wie etwa Psychostimulanzien, Antidiabetika, oralen Antikoagulanzien, Antiepileptika, Protonenpumpenhemmern, anderen schilddrüsenwirksamen Wirkstoffen und mit Wirkstoffen, die über CYP3A4 verstoffwechselt werden.[6]
Schilddrüsenhormonresistenz
In Frankreich war Tiratricol unter dem Namen Téatrois von 1974 bis 2020[2] zur Behandlung einer Schilddrüsenhormonresistenz und zur Suppression der TSH-Sekretion - insbesondere nach Schilddrüsenkrebs - zugelassen.[9]
Missbrauch
Tiratricol wurde zur Gewichtsreduktion missbraucht, etwa in den USA. Dort warnte die zuständige Food and Drug Administration (FDA) ab 1999 vor der Einnahme entsprechender als Nahrungsergänzungsmittel beworbener Präparate und rief verschiedene Produkte vom Markt.[10]
Einzelnachweise
- ↑ INN Recommended List 18. WHO, abgerufen am 15. September 2025 (englisch).
- ↑ a b c d e f Assessment Report Emcitate (PDF) auf ema.europa.eu, Committee for Medicinal Products for Human Use, 12. Dezember 2024.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Tiratricol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. März 2025.
- ↑ a b c S. Groeneweg, R.P. Peeters, T. J. Visser, W. E. Visser: Triiodothyroacetic acid in health and disease. Journal of Endocrinology, Band 234, N. 2, 2017, R99-R121. doi:10.1530/JOE-17-0113.
- ↑ Eintrag EU/1/24/1897 im Unionsregister der Europäischen Kommission. In: ec.europa.eu. 17. Februar 2025, abgerufen am 9. März 2025 (englisch).
- ↑ a b Emicate – Zusammenfassung der Merkmale des Arzneimittels (PDF-Datei) auf ema.europa.eu. Abgerufen am 9. März 2025.
- ↑ EU/3/17/1945 - orphan designation for treatment of Allan-Herndon-Dudley syndrome. In: ema.europa.eu. 15. Januar 2018, abgerufen am 9. März 2025 (englisch).
- ↑ Stefan Groeneweg, Robin P. Peeters, Carla Moran, Athanasia Stoupa, Françoise Auriol, Davide Tonduti, Alice Dica, Laura Paone, Klára Roženková, Jana Malíková, Adri van der Walt, I.F.M. de Coo, Anne McGowan, Greta Lyons, Femke K. Aarsen, Diana Barca, Ingrid M. van Beynum, Marieke M van der Knoop, Jurgen Jansen, Martien Manshande, Roelineke J. Lunsing, S Nowak, Corstiaan A. den Uil, M. Carola Zillikens, Frank E. Visser, P Vrijmoeth, Marie‐Claire Y. de Wit, Nicole I. Wolf, Angelique Zandstra, Gautam Ambegaonkar, Yogen Singh, Yolanda B. de Rijke, Marco Medici, Enrico Bertini, Sylvia Depoorter, Jan Lebl, Marco Cappa, Linda De Meırleır, Heiko Krude, Dana Craiu, Federica Zibordi, Isabelle Petit, Michel Polak, Krishna Chatterjee, Theo J. Visser, W. Edward Visser: Effectiveness and safety of the tri-iodothyronine analogue Triac in children and adults with MCT8 deficiency: an international, single-arm, open-label, phase 2 trial. In: The Lancet Diabetes & Endocrinology. 2019, Band 7, Nummer 9, S. 695–706, DOI:10.1016/S2213-8587(19)30155-X.
- ↑ Vidal: TEATROIS - VIDAL. In: vidal.fr. Abgerufen am 9. März 2025 (französisch).
- ↑ Office of Regulatory Affairs: Center for Food Safety and Applied Nutrition continued 2001. In: fda.gov. 2. März 2016, abgerufen am 9. März 2025 (englisch).