Thermoproteati
| TACK-Superphylum | ||||||||
|---|---|---|---|---|---|---|---|---|

Sulfolobus tengchongensis, | ||||||||
| Systematik | ||||||||
| ||||||||
| Wissenschaftlicher Name | ||||||||
| Thermoproteati | ||||||||
| Guy & Ettema 2024 |



Thermoproteati ist ein 2024 offiziell anerkanntes Reich der Archaeen, das auch unter der informellen Bezeichnung TACK-Superphylum bekannt ist.[1][2]
Das Akronym ‚TACK‘ steht dabei für die Anfangsbuchstaben der ersten entdeckten Mitgliedsgruppen. Diese Gründungsmitglieder sind: Thaumarchaeota (jetzt Nitrososphaerota), Aigarchaeota (jetzt Augarchaeota), Crenarchaeota (jetzt zu Thermoproteota) und Korarchaeota (jetzt ebenfalls zu Thermoproteota); inzwischen wurden jedoch noch weitere Gruppen dieser Klade zugeordnet (s. u.). Die Thermoproteati sind in verschiedenen Umgebungen anzutreffen, angefangen von acidophil-thermophilen (säure- und hitzeliebenden) über mesophile (gemäßigte Bedingungen liebende) bis zu psychrophilen (kälteliebende) Organismen.
Sie weisen unterschiedliche Stoffwechselarten auf, vor allem anaerobe und chemosynthetische.[3]
Die Taxonomie der Thermoproteati ist in Teilen immer noch stark in der Diskussion. Im Jar 2020 war von Thomas Cavalier-Smith und Ema Chao vorgeschlagen worden, die Gruppe als Phylum „Crenarchaeota“ (sensu lato) zu klassifizieren und die traditionellen „Crenarchaeota“ als eine Klasse „Sulfolobia“ anzusehen, zusammen mit den anderen bisherigen Mitglieds-Phyla nun ebenfalls im Rang einer Klassenrang oder nur mehr einer Ordnung (Biologie).[4]
Nach Aufnahme des neuen Rangs ‚Reich‘ (englisch kingdom, lateinisch regnum) in den International Code of Nomenclature of Prokaryotes (ICNP) ist der einzige gültig veröffentlichte Name dieser Gruppe: Reich Thermoproteati Guy & Ettema 2024.[5] Bedeutendste Untergruppe ist des Phylum Thermoproteota, das u. a. die Klassen Thermoprotei („Crenarchaeota“ sensu stricto) und ggf. die Korarchaeia (als eigenes Phylum „Korarchaeota“) umfasst.
Die Thermoproteati sind die Schwesterklade der Asgard-Archaeen (Reich Promethearchaeati, früher als Phylum Asgardarchaeota genannt[6]), aus denen die Eukaryoten hervorgegangen sind. Zusammen bilden sie die Supergruppe der Proteoarchaeen. Nach der in den 1980er Jahren von James Lake vorgeschlagenen Eozyten-Hypothese (Lake et al. 1984) sollen die Eukaryoten sich aus den prokaryotischen Eozyten (ein alter Name, sensu stricto für die Crenarchaeota, sensu lato für die Proteoarchaeen – Asgard-Archaeen kannte man damals noch nicht) entwickelt haben.[7] In den Jahren 2010–2015 wurden (mit den Lokiarchaeen) die ersten Vertreter der Asgard-Archaeen gefunden, wobei sich herausstellte, dass es unter diesen noch engere verwandtschaftliche Beziehungen zu den Eukaryoten gibt als bei den zuvor favorisierten Crenarchaeota (Thermoproteota) oder Thaumarchaeota (Nitrososphaerota) aus TACK.
Mitgliedsgruppen
Die Thermoproteati (TACK-Archaeen) umfassen folgende Phyla:
- Thermoproteota – die bedeutendste Mitgliedsgruppe. Zu ihr gehören u. a. die folgenden Klassen:
- Thermoprotei (früher als Phylum „Crenarchaeota“ sensu stricto) – Es ist die bekannteste Mitgliedsgruppe und stellt die am häufigsten vorkommenden Archaeen im marinen Ökosystem. Sie wurden früher wegen ihrer Abhängigkeit von Schwefel als Sulfobakterien (bzw. Sulfolobia) bezeichnet und sind als Kohlenstofffixierer wichtig. Es gibt unter ihnen Hyperthermophile in hydrothermalen Schloten, andere Gruppen sind jedoch am häufigsten in Tiefen von weniger als 100 m anzutreffen.
- Thermoprotei_A – in der GTDB eine Abspaltung von der Klasse Thermoprotei, die nur die Ordnungen Marsarchaeales, Sulfolobales und o_EX4484-217-1 enthält.
- „Ca. Korarchaeia“ (als Phylum „Ca. Korarchaeota“) – Sie wurden nur in hydrothermalen Umgebungen und in geringer Abundanz gefunden. Sie scheinen je nach Temperatur, Salzgehalt (Süß- oder Meerwasser) und Geographie phylogenetisch diversifiziert zu sein.
- Nitrososphaeria (früher als Phylum „Nitrososphaerota“ und „Thaumarchaeota“)[8][9][10] – Diese Gruppe umfasst mesophile oder psychrophile Organismen (d. h. solche, die bei mittleren und niedrigen Temperaturen gedeihen), mit einem Ammoniak-oxidierenden „chemolytoautotrophen“ (nitrifizierenden) Stoffwechsel, daher die frühere Bezeichnung Ammonia-oxidizing [thaum]archaeota, (AOA).[11] Sie spielen wahrscheinlich eine wichtige Rolle in biochemischen Kreisläufen, wie dem Stickstoff- und Kohlenstoffkreislauf.
- Nitrososphaeria_A (GTDB) (als Phylum nach der LPSN Augarchaeota, früher „Aigarchaeota“) – Es handelt sich um eine anhand der Genomsequenz 10-H-08 der Kandidatenspezies „Ca. Caldiarchaeum subterraneum“,[1] ursprünglich als Phylum vorgeschlagene Gruppe. Diese gensequenz wurde tief in einer Goldmine in Japan gefunden; Genomsequenzen dieser als Nitrososphaerota-Ordnung Caldarchaeales (früher auch Caldiarchaeales) genannten Gruppe wurden aber auch in geothermischen Umgebungen gefunden, sowohl auf dem Land (terrestrisch) als auch im Meer (marin).
- In der LPSN gehört die Gattung Ca. Calditenuis ohne nähere Zuordnungen zum Phylum Ca. Augarchaeota [Ca. Aigarchaeota], die Gattungen Ca. Caldarchaeum und Ca. Pelearchaeum gehören dagegen mit ihrer Familie Ca. Caldarchaeaceae der Ordnung Ca. Caldarchaeales zur Klasse Nitrososphaeria des Phylums Thermoproteota.
- In der Taxonomie des NCBI sind die drei Gattungen vereint in der Familie Ca. Calditenuaceae der Ordnung Caldarchaeales (ohne Klassenzuweisung) im Phylum Nitrososphaerota.
- Nach der GTDB gehört die Gattung Ca. Calditenuis zur Familie Ca. Calditenuaceae, die Gattungen Ca. Caldarchaeum und Ca. Pelearchaeum zur Familie Ca. Caldarchaeaceae. Beide Familien sind in der Ordnung Ca. Caldarchaeales vereint, jedoch in einer Klasse Nitrososphaeria_A des Phylums Thermoproteota.
- In einer Konsens-Systematik wäre LPSN mit der GTDB zu ergänzen, wobei Nitrososphaeria_A vom Umfang her den Aigarchaeota/Augarchaeota entspräche.
- In der LPSN gehört die Gattung Ca. Calditenuis ohne nähere Zuordnungen zum Phylum Ca. Augarchaeota [Ca. Aigarchaeota], die Gattungen Ca. Caldarchaeum und Ca. Pelearchaeum gehören dagegen mit ihrer Familie Ca. Caldarchaeaceae der Ordnung Ca. Caldarchaeales zur Klasse Nitrososphaeria des Phylums Thermoproteota.
- Weitere Mitgliedsgruppen der Thermoproteota:
- „Ca. Bathyarchaeia“ (Miscellaneous Crenarchaeotal Group, MCG);[12] in der LPSN und der GTDB eine weitere Klasse der Thermoproteota, in der NCBI-Taxonomie in einem eigenen Phylum „Ca. Bathyarchaeota“[A. 1] – Sie kommen reichlich in den nährstoffarmen Sedimenten des Meeresbodens vor. Zumindest einige Linien entwickeln sich nach Fengping Wang et al. (2016) durch Homoacetogenese, eine Art des Stoffwechsels, von der man bisher annahm, er sei nur bei Bakterien zu finden. Provisorische Unterteilung in die Gruppen mit den Gruppen MCG-1, MCG-6, MCG-15[10]
- „Ca. Methanomethylicia“ (früher auch „Ca. Methanomethylia“ oder provisorisch Terrestrial Miscellaneous Crenarchaeota Group, TMCG; in der LPSN und GTDB Klasse der Thermoproteota, in der NCBI-Taxonomie in eigenem Phylum Methanomethylicota, dieser Name ist in der LPSN ebenso wie Verstraetearchaeota ein Synonym für Thermoproteota)[13][14][15][16][12] – Eine Gruppe von Archaeen, die anoxische Umgebungen mit hohen Methandurchsätzen bewohnt. Beinhaltet „Ca. Methanomethylicales“ und einige weitere verwandte Gruppen: „Ca. Methanohydrogenicales“, „Ca. Methanomediales“, „Ca. Methanomethyloarchaeales“, „Ca. Methanomethylovorales“. Die früher als Verstraetearchaeota (mit Typusgattung „Ca. Methanomethylicus“) bezeichnete Klade stimmt inhaltlich mit den Methanomethylicia überein.
Weitere vorgeschlagene Mitgliedsgruppen, ggf. im Rang eines Phylums:
- „Ca. Nezhaarchaeota“ (nach LPSN & NCBI im Reich Thermoproteati, in der GTDB als Nezhaarchaeales ebenfalls in der Klasse Methanomethylicia des Phylums Thermoproteota)[17][16] – Eine mögliche Ordnung der Methanomethylicia innerhalb der Thermoproteota.
- „Ca. Geothermarchaeota“ (früher provisorisch Terrestrial Hot Springs Crenarchaeotic Group Takai & Horikoshi 1999, THSCG; nach LPSN & NCBI in Thermoproteati, in der GTDB Ordnung Geothermarchaeales in der Klasse Nitrososphaeria, Phylum Thermoproteota)[18][19][20][21] – Diese Gruppe wurde 2017 aus den (damaligen) Crenarchaeota ausgegliedert.[21]
- „Ca. Brockiarchaeota“ (früher „Ca. Brockarchaeota“, in der GTDB Klasse c__EX4484-205 der Thermoproteota)[19][A. 2][22] – Sie kommen in heißen Quellen und Sedimenten in Geothermalgebieten vor und verarbeiten anaerob abgestorbene Pflanzenreste, aber ohne das Treibhausgas Methan freizusetzen. Damit könnten sie eine wichtige Rolle in der Zukunft bei der Bekämpfung der Klimaerwärmung spielen.[19]
- „Ca. Culexarchaeota“ (LPSN: unbekannt, nach NCBI im Reich Thermoproteati, in der GTDB als Culexarchaeales zu den Methanomethylicia)[23][24]
- „Ca. Geoarchaeota“ (LPSN incertae sedis, NCBI im Reich Thermoproteati, in der GTDB als Gearchaeales in der Klasse Thermoprotei) – Diese Gruppe umfasst thermophile Organismen, die in saurem Milieu leben und Eisen reduzieren. Alternativ wurde vorgeschlagen, dass diese und ggf. weitere Gruppen eigentlich zum Phylum Thaumarchaeota (d. h. Nitrososphaerota) gehören.
- „Ca. Martarchaeota“ (früher „Ca. Marsarchaeota“, LPSN incertae sedis, NCBI im Reich Thermoproteati, in der GTDB Ordnung Marsarchaeales in der Abspaltungs-Klasse Thermoprotei_A) – Eine thermophile, aerobe Archaeenlinie, die in geothermischen Eisenoxid-Mikrobenmatten häufig vorkommt. Sie wurde im Yellowstone National Park in saurem Milieu bei Temperaturen von 50 bis 80 °C gefunden. Sie sind fakultativ aerobe Chemoorganotrophe, die auch Fe(III)-Reduktion durchführen können.
Systematik
Als wissenschaftliche Bezeichnung für die TACK-Supergruppe wurden mit dem taxonomischen Rang eines Superphylums (Überabteilung) oder darunter vorgeschlagen: „Crenarcheida“ (Luketa 2012), „Filarchaeota“ (Cavalier-Smith 2014), „Thermoproteota“ (s. u.), „Thermoproteaeota“ (s. u.) oder Crenarchaeota (sensu lato, Cavalier-Smith 2020) vorgeschlagen (im letzteren Fall sollen die Crenarchaeota vom Phylum zu einer Klasse Sulfolobia herabgestuft werden, ebenso sollen die anderen TACK-Mitgliedsphyla zu Klassen oder Ordnungen herabgestuft werden).[4]
Nach Einführung der taxonomischen Rangstufe Reich auch für Prokaryoten wurde 2024 die Bezeichnung Thermoproteati als einzig gültiger Name festgelegt.[1] Für die beiden Reiche (früher Superphyla)[25] Thermoproteati („TACK“) und Promethearchaeati (Asgard) wurde als umfassende taxonomische Einheit der Name „Proteoarchaea“[26] (früher „Proteoarchaeota“[27]) vorgeschlagen.
Die Systematik nach der LPSN (ergänzt nach der Taxonomie des NCBI und der GTDB) ist damit wie folgt (Stand 14. Juni 2025):[1][2][28][29]
Reich Thermoproteati Guy & Ettema 2024 [früher TACK-Superphylum – „Crenarchaeida“ Luketa 2012, „Korarchaeota“ Barns et al. 1996,[10] „Proteoarchaeota“ Petitjean et al. 2014]
- Phylum „Candidatus Nezhaarchaeota“ Wang et al. 2019
- Klasse „Ca. Nezhaarchaea“ Wang Hua et al. 2019
- Ordnung „Ca. Nezhaarchaeales“ Wang Hua et al. 2019
- Familie „Ca. Methanohydrogenotrophicaceae“ Wang Hua et al. 2019
- Gattung „Ca. Methanogeoarchaeum“ Wang Hua et al. 2019
- Spezies „Ca. Methanogeoarchaeum hydrogenovorans“ Wang Hua et al. 2019, mit
- Stamm ZMQR bin_18 (LPSN)
- Spezies „Ca. Methanogeoarchaeum hydrogenovorans“ Wang Hua et al. 2019, mit
- Gattung „Ca. Methanohydrogenotrophicum“ Wang Hua et al. 2019
- Spezies „Ca. Methanohydrogenotrophicum pristinum“ Wang Hua et al. 2019, mit
- Stamm JZ bin_66 (LPSN)
- Spezies „Ca. Methanohydrogenotrophicum pristinum“ Wang Hua et al. 2019, mit
- Gattung „Ca. Methanogeoarchaeum“ Wang Hua et al. 2019
- Familie „Ca. Methanohydrogenotrophicaceae“ Wang Hua et al. 2019
- Ordnung „Ca. Nezhaarchaeales“ Wang Hua et al. 2019
- Klasse „Ca. Nezhaarchaea“ Wang Hua et al. 2019
- Phylum Thermoproteota Garrity & Holt 2021[30] [bzw. „Thermoproteota“ Whitman et al. 2018, „Thermoproteaeota“ Oren et al. 2015, „Crenarchaeota“ Garrity & Holt 2001 — „Ca. Geothermarchaeota“ Jungbluth et al. 2017, „Ca. Korarchaeota“ Ludwig & Klenk 2001,[10] „Xenarchaeota“[10] „Nitrososphaeraeota“ Oren et al. 2015 bzw. Nitrososphaerota Brochier-Armanet et al. 2021 oder „Nitrososphaerota“ Whitman et al. 2018, „Ca. Thaumarchaeota“ Brochier-Armanet et al. 2008, „Ca. Methanomethylicota“ corrig. Vanwonterghem et al. 2016, „Ca. Verstraetearchaeota“ Vanwonterghem et al. 2016]
- Phylum „Ca. Culexarchaeota“ Kohtz et al. 2022 (NCBI)[23][24][A. 3]
- Klasse „Ca. Culexarchaeia“ Kohtz et al. 2022 (NCBI, nach der GTDB sogar ein Synonym zu „Methanomethylicia“)
- Ordnung „Ca. Culexarchaeales“ Kohtz et al. 2022 (NCBI & GTDB)
- Familie „Ca. Culexarchaeaceae“ Kohtz et al. 2022 (NCBI & GTDB) – terrestrisch[24]
- Gattung „Ca. Culexarchaeum“ Kohtz et al. 2022 (NCBI & GTDB)
- Spezies „Ca. Culexarchaeum jinzeense“ Kohtz et al. 2022, mit
- Stamm JZ-Bin-30 alias JZ Bin 30 oder Ga0181710 – Fundort: Geothermalquelle JinZe (Tengchong) in Yunnan, China
- Spezies „Ca. Culexarchaeum nevadense“ Kohtz et al. 2022 [Archaeon GBS-70-058], mit
- Stamm GBS-70-058 alias Ga0197143 – Fundort: Great Boiling Springs (NCBI & GTDB)
- Spezies „Ca. Culexarchaeum yellowstonense“ Kohtz et al. 2022 [Archaeon YNP-LCB-024-027] (Typusart),[24] mit
- Stamm NP-LCB-24-027 alias YNP-LCB-024-027 oder Ga0272449 – Fundort: Lower Culex Basin, Yellowstone-Nationalpark (NCBI & GTDB)
- Stamm YNP-LCB-3-016 alias YNP-LCB-003-016 – Fundort: Lower Culex Basin, Yellowstone-Nationalpark (NCBI & GTDB)
- Stamm YNP-WB-040 – Fundort: Washburn Hot Springs, Yellowstone-Nationalpark (NCBI & GTDB)
- Stamm YNP-WB-062 – Fundort: Washburn Hot Springs, Yellowstone-Nationalpark (NCBI & GTDB)
- Spezies Culexarchaeum sp038727515 (GTDB) [Ca. Methanomethylicia archaeon isolate DRTY-2_202007_bins_12 (NCBI)], mit
- Stamm DRTY-2_202007_bins_12 – Fundort: Sediment einer Thermalquelle bei Tengchong in Yunnan, China
- Spezies Culexarchaeum sp025058215 (GTDB) [Ca. Methanomethylicia archaeon isolate SKYB69 (NCBI)], mit
- Stamm SKYB69 – Fundort: Sunkai, Perak, Malaysia
- Spezies Culexarchaeum sp020833005 (GTDB) [Ca. Methanomethylicota archaeon isolate Bin S2 (NCBI)], mit
- Stamm Bin S2 – Fundort: Quelle GGS063, Scalloped Spring, Geyser Springs Group, Yellowstone-Nationalpark
- Spezies „Ca. Culexarchaeum jinzeense“ Kohtz et al. 2022, mit
- Gattung „Ca. Culexarchaeum“ Kohtz et al. 2022 (NCBI & GTDB)
- Familie „Ca. Culexmicrobiaceae“ Kohtz et al. 2022 (NCBI & GTDB) – marin[24]
- Gattung „Ca. Culexmicrobium“ Kohtz et al. 2022 (NCBI & GTDB)
- Spezies „Ca. Culexmicrobium cathedralense“ Kohtz et al. 2022 [Archaeon GB-1867-005] (Typusart),[24] mit
- Stamm GB-1867-005 (NCBI & GTDB) – Fundort: Guaymas-Becken, Golf von Kalifornien, Mexiko
- Spezies „Ca. Culexmicrobium profundum“ Kohtz et al. 2022 [Archaeon GB-1867-035], mit
- Stamm GB-1867-035 (NCBI & GTDB) – Fundort: Guaymas-Becken, Golf von Kalifornien, Mexiko
- Spezies „Ca. Culexmicrobium thermophilum“ Kohtz et al. 2022, mit
- Spezies „Ca. Culexmicrobium cathedralense“ Kohtz et al. 2022 [Archaeon GB-1867-005] (Typusart),[24] mit
- Gattung „Ca. Culexmicrobium“ Kohtz et al. 2022 (NCBI & GTDB)
- Familie „Ca. Culexarchaeaceae“ Kohtz et al. 2022 (NCBI & GTDB) – terrestrisch[24]
- Ordnung „Ca. Culexarchaeales“ Kohtz et al. 2022 (NCBI & GTDB)
- Klasse „Ca. Culexarchaeia“ Kohtz et al. 2022 (NCBI, nach der GTDB sogar ein Synonym zu „Methanomethylicia“)
- Phylum „Ca. Geoarchaeota“ Kozubal et al. 2013[31][10] (LPSN keinem Reich zugeordnet) [Gearchaeota, früher Novel archaeal group I, NAG1[12]][32][A. 4]
- Phylum „Ca. Martarchaeota“ corrig. Jay et al. 2018 [„Ca. Marsarchaeota“ Jay et al. 2018][33][10][A. 5]
- Phylum „Ca. Brockiarchaeota“ corrig. De Anda et al. 2021 (LPSN) [„Ca. Brockarchaeota“De Anda et al. 2021 (LPSN & NCBI), c__EX4484-205 (GTDB)]
- Klasse c__EX4484-205 (GTDB)
- Ordnung o__EX4484-205 (GTDB)
- Familie f__DTQO01
- Gattung DTQO01
- Spezies DTQO01 sp017601265 [Ca. Brockarchaeota archaeon isolate JZ-2.bins.136 (NCBI)], mit
- Stamm JZ-2.bins.136
- Spezies DTQO01 sp017601265 [Ca. Brockarchaeota archaeon isolate JZ-2.bins.136 (NCBI)], mit
- Gattung DTQO01
- Familie f__JAAOZO01
- Gattung JAAOZO01
- Spezies JAAOZO01 sp017601145 [Ca. Brockarchaeota archaeon isolate DRTY-1.bins.18 (NCBI)], mit
- Stamm DRTY-1.bins.18
- Spezies JAAOZO01 sp017601145 [Ca. Brockarchaeota archaeon isolate DRTY-1.bins.18 (NCBI)], mit
- Gattung JAAOZO01
- Familie f__JAAOZP01
- Gattung JAAOZP01
- Spezies JAAOZP01 sp017601225 [Ca. Brockarchaeota archaeon isolate DRTY-6.bins.80 (NCBI)], mit
- Stamm DRTY-6.bins.80
- Spezies JAAOZP01 sp011363915 [Ca. Brockarchaeota archaeon isolate JZZ.bins.4 (NCBI)], mit
- Stamm JZZ.bins.4
- Spezies JAAOZP01 sp017601345 [Ca. Brockarchaeota archaeon isolate QC4_43 (NCBI)], mit
- Stamm QC4_43
- Spezies JAAOZP01 sp017601395 [Ca. Brockarchaeota archaeon isolate GD2_1 (NCBI)], mit
- Stamm GD2_1
- Spezies JAAOZP01 sp017601225 [Ca. Brockarchaeota archaeon isolate DRTY-6.bins.80 (NCBI)], mit
- Gattung JAAOZP01
- Familie f__DTQO01
- Ordnung o__EX4484-205 (GTDB)
- Klasse c__EX4484-205 (GTDB)
- Phylum „Candidatus Nezhaarchaeota“ Wang et al. 2019
- Klasse „Candidatus Nezhaarchaea“ Hua et al. 2019 (nach der GTDB ein Synonym zu „Methanomethylicia“)
- Ordnung „Candidatus Nezhaarchaeales“ Hua et al. 2019
- Familie „Candidatus Methanohydrogenotrophicaceae“ Hua et al. 2019
- Gattung „Ca. Methanogeoarchaeum“ Hua et al. 2019
- Spezies „Ca. Methanogeoarchaeum hydrogenovorans“ Hua et al. 2019, mit
- Stamm ZMQR bin_18
- Spezies „Ca. Methanogeoarchaeum hydrogenovorans“ Hua et al. 2019, mit
- Gattung „Ca. Methanohydrogenotrophicum“ Hua et al. 2019
- Spezies „Ca. Methanohydrogenotrophicum pristinum“ Hua et al. 2019, mit
- Stamm JZ bin_66 alias Ga0263245
- Spezies „Ca. Methanohydrogenotrophicum pristinum“ Hua et al. 2019, mit
- Gattung „Ca. Methanogeoarchaeum“ Hua et al. 2019
- Familie f__WYZ-LMO8 (GTDB)
- Gattung WYZ-LMO8 (GTDB)
- Spezies WYZ-LMO8 sp004347965 (GTDB) [„Ca. Nezhaarchaeota archaeon WYZ-LMO7“ (NCBI)], mit
- Stamm WYZ-LMO7
- Spezies WYZ-LMO8 sp004347965 (GTDB) [„Ca.Nezhaarchaeota archaeon WYZ-LMO8“ (NCBI)], mit
- Stamm WYZ-LMO8
- Spezies WYZ-LMO8 sp004347965 (GTDB) [„Ca. Nezhaarchaeota archaeon WYZ-LMO7“ (NCBI)], mit
- Gattung WYZ-LMO8 (GTDB)
- Familie „Candidatus Methanohydrogenotrophicaceae“ Hua et al. 2019
- Ordnung „Candidatus Nezhaarchaeales“ Hua et al. 2019
- Klasse „Candidatus Nezhaarchaea“ Hua et al. 2019 (nach der GTDB ein Synonym zu „Methanomethylicia“)
Anmerkungen:
- Die Tendenz war früher, neuen Kladen mit dem Rang eines Phylums (Endung „-archaota“) zu versehen. Die Taxonomie seit 2024 hat für Superphyla den Rang Reich (englisch kingdom, lateinisch regnum) hinzugefügt (s. o.), aber gleichzeitig viele Kladen im Rang eines Phylums zu Klassen „degradiert“.
- Die vielen Synonyme der wissenschaftlichen Bezeichnung Promethearchaeati resultieren u. a. daher, dass einige Mitgliedskladen früher im Rang eines Phylums gesehen wurden, und ihr Bezeichner ein entsprechendes Suffix (‚-ota‘, meist ‚-archaeota‘) trug. Wenn diese Kladen heute als Klassen (mit einem entsprechenden neuen Suffix, etwa ‚-archaeia‘) im ein und demselben Phylum gesehen werden, dann werden die alten Bezeichner auf der Rang-Ebene der Phyla formal zu Synonymen für das heutige gemeinsame Phylum. Die inhaltliche Entsprechung ist aber die eines Subsets (z. B. Klasse). In der obigen Liste sind diese formalen Synonyme von inhaltlichen durch einen Bindestrich (‚—‘) abgesetzt.
Phylogenie
Mit weiteren Sequenzierungen bzw. Metagenomik-Dazen zeichnet sich folgende Entwicklung der nach jeweiligem Stand plausibelsten Phylogenie ab:
| McKay et al. (2019)[34] | 16S-rRNA-basiert (2023)[35] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
| AnnoTree und GTDB-Release 09-RS220[36] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Die unterschiedlichen Suffixe für gleiche Gruppen sind eine Folge der von den Autoren unterschiedlich vergebenen taxonomischen Rangstufen, siehe Lumper und Splitter.[A. 6]
Nach Zhang et al. (2025) bilden die Njordarchaeen eine Schwesterordnung Njordarchaeales der Korarchaeales.[37]
Eozyten-Hypothese
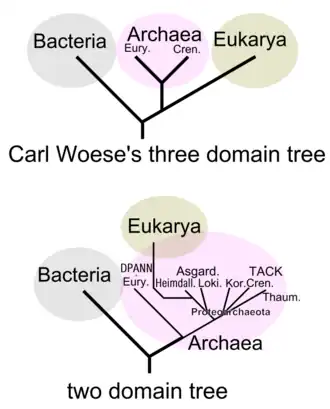
Die in den 1980er Jahren von James Lake vorgeschlagene Eozyten-Hypothese legt nahe, dass sich die Eukaryoten (Zellen mit komplexem Aufbau und Vielzeller wie Pflanzen, Pilze und Tiere, insbesondere auch der Mensch) aus den prokaryotischen Eozyten (ein alter Name für Crenarchaeota) entwickelten.[7][39][40]
Die V-Typ ATPase der Eukaryoten ähnelt der A-Typ ATP-Synthase der Archaeen – eine Tatsache, die einen Ursprung der Eukaryonten unter den Archaeen nahelegt. Die Ähnlichkeiten zu den bei Bakterien, Chloroplasten und Mitochondrien anzutreffenden F-Typ ATP-Synthasen sind dagegen weitaus geringer (das ausnahmsweise Auftreten des F-Typs bei einigen Archaeenlinien und des A-Typs bei einigen Bakterienlinien wird als Folge horizontalen Gentransfers angesehen).[41]
Proteasom genannte Proteinkomplexe haben offenbar bei dem Thermoproteota-Mitglied Sulfolobus acidocaldarius in der Zellteilung die gleiche Funktion wie bei Eukaryoten.[42]
Ein Hinweis auf eine enge Beziehung zwischen Thermoproteota und Eukaryoten ist das Vorhandensein eines Homologs der RNA-Polymerase-Untereinheit Rbp-8[43] in Vertretern der Thermoproteota, die aber nicht in Archaeen des Reichs Methanobacteriati (alias Superphylum „Euryarchaeida“) zu finden ist.[44]
Schon mit der Entdeckung weiterer den (ursprünglich entdeckten) Thermoprotei nahestehenden Archaeengruppen innerhalb des Superphylums „TACK“ wurde spekuliert, ob diese den Eukaryoten vielleicht noch näher stehen könnten. Tatsächlich wurden in der „TACK“-Schwestergruppe der Asgard-Archaeen (etwa die Hodarchaeales[45]) gefunden, die den Eukaryoten noch wesentlich näher stehen.[46][47] Diese Ergebnisse konkretisieren die Aussage der Endosymbiontentheorie bzgl. der Herkunft des letzten gemeinsamen Vorfahren der Eukaryoten (Last Eukaryotic Common Ancestor, LECA), auch wenn die Verwandtschaftsbeziehungen immer noch im Detail diskutiert werden.[38][48]
Eine im Herbst 2020 veröffentlichte Studie legt anhand von umfangreichen Genomanlysen tatsächlich nahe, dass – obwohl bisher noch keine primär amitochondrialen Eukaryoten gefunden wurden – die Vorfahren der Eukaryonten aus der Verwandtschaft der Asgard-Archaeen zuerst ihr komplexes Genom mit den zugehörigen Strukturen, und danach die Mitochondrien (oder Vorläufer davon) erworben haben.[49]
Anfang 2022 veröffentlichten Akıl et al Metagenom-Analysen aus dem Sediment einer heißen Quelle („Unteres Culex-Becken“, engl. Lower Culex Basin[50]) im Yellowstone-Nationalpark (USA). Aufgrund dieser Analysen kodiert die Odinarchaeota-Spezies „Ca. Odinarchaeum yellowstonii“ (alias Ca. Odinarchaeota archaeon LCB_4),[51][52] vorhergesagt für zwei prokaryotische FtsZ-Zellteilungsproteine sowie für ein weiteres, OdinTubulin genanntes Protein. Dieses zeigt Homologie sowohl zu eukaryotischen Tubulinen, als auch (weniger stark) zu Ftsz-Proteinen und wird daher von den Autoren als eine Übergangsform zwischen den FtsZ-Proteinen und den Tubulinen angesehen.[53] Im November 2022 wurde bekannt, dass die Odinarchaeota darüber hinaus ein Protein OdinAK besitzen, das mit der Adenylat-Kinase AK6 des Menschen verwandt ist.[54]
Im Juli 2023 wurden dann von Laura Eme et al. die Hodarchaeales unter den Heimdallarchaeen als nächste Verwandte der Eukaryoten unter den bis dato bekannten Archaeen vorgeschlagen.[45] Thang et al. (2025) vermutem jedoch einen Ursprung der Eukaryoten tief in den Asgard-Archaeen außerhalb der Heimdall-Archaeen.[37]
Anmerkungen
- ↑ Der verwaiste LPSN-Eintrag zu
- "Candidatus Bathyarchaeota" Meng et al. 2014
- ↑ Der Eintrag zum Phylum ist in der LPSN verwaist, in der NCBI-Taxonomie gehört das Phylum zum Reich Thermoproteati. Kein Eintrag zu ‚Brockarch…‘ oder …‚Brockiarch…‘ in der GTDB Klasse c__EX4484-205 des Phylums Thermoproteota.
- ↑ In der GTDB rebgert diese Klade als Ordnung Culexarchaeales in der Klasse Methanomethylicia.
- ↑ in der GTDB zur Klasse Thermoprotei.
- ↑ In der GTDB rangiert diese Klade als Ordnung Marsarchaeales in der Klasse Thermoprotei_A [Sulfolobia] (Abspaltung von Thermoprotei).
- ↑ Lumper tendieren dazu, biologisch diverse Gruppen in einem Taxon niedrigerer Rangstufe zusammenzufassen; Splitter tendieren umgekehrt dazu, Gruppen auch bei geringen Abweichungen in der Gensequenz aufzuspalten.
Weblinks
- Wen-Cong Huang, Maraike Probst, Zheng-Shuang Hua, Lénárd L. Szánthó, Gergely J. Szöllősi, Thijs J. G. Ettema, Christian Rinke, Tom A. Williams, Anja Spang: Phylogenomic analyses reveal that Panguiarchaeum is a clade of genome-reduced Asgard archaea within the Njordarchaeia. Auf: bioRχiv; Preprint vom 17. Februar 2024 (v1). Stand: 22. Mai 2025 (v2); doi:10.1101/2025.02.13.637844 (englisch).
Einzelnachweise
- ↑ a b c d LPSN: Kingdom Thermoproteati Guy and Ettema 2024.
- ↑ a b National Center for Biotechnology Information Taxonomy Browser: Thermoproteati, Details: Thermoproteati Guy and Ettema 2024 (kingdom), heterotypic synonym: "Crenarchaeida" Luketa 2012, common name(s): TACK group; graphisch: Thermoproteati (TACK group), auf: Lifemap, NCBI Version.
- ↑ Lionel Guy, Thijs J. G. Ettema: The archaeal 'TACK' superphylum and the origin of eukaryotes. In: Trends in Microbiology, Band 19, Nr. 12, Dezember 2011, S. 580–587; doi:10.1016/j.tim.2011.09.002, PMID 22018741 (englisch).
- ↑ a b Thomas Cavalier-Smith, Ema E-Yung Chao: Multidomain ribosomal protein trees and the planctobacterial origin of neomura (Eukaryotes, archaebacteria). In: Protoplasma. 257. Jahrgang, Nr. 3, 3. Januar 2020, S. 621–753, doi:10.1007/s00709-019-01442-7, PMID 31900730, PMC 7203096 (freier Volltext) – (englisch).
- ↑ Markus Göker, Aharon Oren: Valid publication of names of two domains and seven kingdoms of prokaryotes. In: International Journal of Systematic and Evolutionary Microbiology. 74. Jahrgang, Nr. 1, 22. Januar 2024, ISSN 1466-5026, ResearchGate:377596825, doi:10.1099/ijsem.0.006242, PMID 38252124 (englisch).
- ↑ Paul-Adrian Bulzu, Adrian-Stefan Andrei, Michaela M. Salcher, Maliheh Mehrshad, Keiichi Inoue, Hideki Kandori, Oded Beja, Rohit Ghai, Horia L. Banciu: Casting light on Asgardarchaeota metabolism in a sunlit microoxic niche. In: Nature Microbiology, Band 4, 1. April 2019, S. 1129–1137; doi:10.1038/s41564-019-0404-y, PMID 30936485 (englisch).
- ↑ a b
James A. Lake, Eric Henderson, Melanie Oakes, Michael W. Clark: Eocytes: a new ribosome structure indicates a kingdom with a close relationship to eukaryotes. In: PNAS, Band 81, Nr. 12, Juni 1984, S. 3786–3790; doi:10.1073/pnas.81.12.3786, PMC 345305 (freier Volltext), PMID 6587394 (englisch). Dazu:
- Jim Lake: (UCLA) The origin of the nucleus and the tree of life, UCLA. Memento im Web-Archiv vom 7. Februar 2003 (englisch).
- ↑ NCBI Taxonomy Browser: Thaumarchaeota (phylum).
- ↑ Céline Brochier-Armanet, Bastien Boussau, Simonetta Gribaldo, Patrick Forterre: Mesophilic crenarchaeota: Proposal for a third archaeal phylum, the Thaumarchaeota. In: Nature Reviews Microbiology. Band 6, Nr. 3, März 2008, S. 245–252, doi:10.1038/nrmicro1852, PMID 18274537 (englisch).
- ↑ a b c d e f g Cindy J. Castelle, Jillian F. Banfield: Major New Microbial Groups Expand Diversity and Alter our Understanding of the Tree of Life. In: Cell. 172. Jahrgang, Nr. 6, 8. März 2018, S. 1181–1197, doi:10.1016/j.cell.2018.02.016, PMID 29522741 (englisch).
- ↑ Rüdiger Ortiz Álvarez, Emilio O. Casamayor: High occurrence of Pacearchaeota and Woesearchaeota (Archaea superphylum DPANN) in the surface waters of oligotrophic high-altitude lakes. In: Environmental Microbiology Reports. 8. Jahrgang, Nr. 2, April 2016, ResearchGate:288701274, S. 210–217, doi:10.1111/1758-2229.12370, PMID 26711582 (englisch).
- ↑ a b c Panagiotis S. Adam, Guillaume Borrel, Céline Brochier-Armanet, Simonetta Gribaldo: The growing tree of Archaea: new perspectives on their diversity, evolution and ecology. In: The ISME journal. Band 11, Nr. 11, November 2017, ISSN 1751-7370, S. 2407–2425, doi:10.1038/ismej.2017.122, PMID 28777382, PMC 5649171 (freier Volltext) – (englisch).
- ↑ Bojk A. Berghuis, Feiqiao Brian Yu, Frederik Schulz, Paul C. Blainey, Tanja Woyke, Stephen R. Quake: Hydrogenotrophic methanogenesis in archaeal phylum Verstraetearchaeota reveals the shared ancestry of all methanogens. In: PNAS, Band 116, Nr. 11, 12. März 2019, S. 5037–5044; doi:10.1073/pnas.1815631116, PMC 6421429 (freier Volltext), PMID 30814220, Epub 27. Februar 2019 (englisch).
- ↑ Luis H. Orellana, T. Ben Francis, Karen Krüger, Hanno Teeling, Marie-Caroline Müller, Bernhard M. Fuchs, Konstantinos T. Konstantinidis, Rudolf I. Amann: Niche differentiation among annually recurrent coastal Marine Group II Euryarchaeota. In: ISME Journal, Band 13, S. 3014–3036, 26. August 2019; doi:10.1038/s41396-019-0491-z (englisch). Siehe insbes. Fig. 1a.
- ↑ Yinzhao Wang, Gunter Wegener, Jialin Hou, Fengping Wang, Xiang Xiao: Expanding anaerobic alkane metabolism in the domain of Archaea. In: Nature Microbiology, Band 4, S. 595–602, vom 4. März 2019, doi:10.1038/s41564-019-0364-2 (englisch).
- ↑ a b Inka Vanwonterghem, Paul N. Evans, Donovan H. Parks, Paul D. Jensen, Ben J. Woodcroft, Philip Hugenholtz, Gene W. Tyson: Methylotrophic methanogenesis discovered in the archaeal phylum Verstraetearchaeota. In: Nature Microbiology, Band 1, Nr. 16170, 3. Oktober 2016; doi:10.1038/nmicrobiol.2016.170, PMID 27694807 (englisch).
- ↑ Fengping Wang: Behind the Paper: Expanding anaerobic alkane metabolism in the domain of Archaea. Auf: Springer Nature Communities (Nature Microbiology Community), 4. März 2019; Memento im Webarchiv vom 22. April 2019 (englisch).
- ↑ Ken Takai, Koki Horikoshi: Genetic diversity of archaea in deep-sea hydrothermal vent environments. In: Genetics, Band 152, Nr. 4, August 1999, S. 1285–1297; doi:10.1093/genetics/152.4.1285, PMC 1460697 (freier Volltext), PMID 10430559 (englisch).
- ↑ a b c
Valerie De Anda, Lin-Xing Chen, Nina Dombrowski, Zheng-Shuang Hua, Hong-Chen Jiang, Jillian F. Banfield, Wen-Jun Li, Brett J. Baker: Brockarchaeota, a novel archaeal phylum with unique and versatile carbon cycling pathways. In: Nature Communications, Band 12, Nr. 2404, 23. April 2021; doi:10.1038/s41467-021-22736-6 (englisch). Siehe insbes. Fig. 1, interaktiv. Dazu:
- Elena Bernard: Neuer Stamm von Mikroben entdeckt. Auf: scinexx.de vom 28. April 2021.
- Climate-friendly microbes chomp dead plants without releasing heat-trapping methane. Auf: Phys.org vom 23. April 2021.
- Newly Discovered Climate-Friendly Microbes Chomp Dead Plants Without Releasing Heat-Trapping Methane. Auf: SciTechDaily vom 23. April 2021.
- Brooks Hays: Climate-friendly microbes break down dead plants, but don't release methane. Auf: UPI vom 23. April 2021.
- ↑ UniProt: Candidatus Geothermarchaeota (PHYLUM).
- ↑ a b NCBI Taxonomy Browser: Candidatus Geothermarchaeota, Details: "Candidatus Geothermarchaeota" Jungbluth et al. 2017 (phylum).
- ↑ GTDB: Search: "Brockarch…"; Search: "Brockiarch…".
- ↑ a b NCBI Taxonomy Browser: Candidatus Culexarchaeota. Typusart und Referenzstamm: NCBI Nucleotide: MAG: Candidatus Culexarchaeum yellowstonense isolate YNP-LCB-24-027.
- ↑ a b c d e f Anthony J. Kohtz, Zackary J. Jay, Mackenzie M. Lynes, Viola Krukenberg, Roland Hatzenpichler: Culexarchaeia, a novel archaeal class of anaerobic generalists inhabiting geothermal environments. In: ISME Communications, Band 2, Nr. 86, 20. September 2022; doi:10.1038/s43705-022-00175-8 (englisch). Siehe insbes. Supplement Fig. 1.
- ↑ NCBI Taxonomy Browser: "Archaea" Woese et al. 1990 (superkingdom).
- ↑ Jonathan Lombard: The multiple evolutionary origins of the eukaryotic N-glycosylation pathway. In: Biology Direct, Band 11, Nr. 36, August 2016; doi:10.1186/s13062-016-0137-2 (englisch).
- ↑ Céline Petitjean, Philippe Deschamps, Purificación López-García, David Moreira: Rooting the Domain archaea by phylogenomic analysis supports the foundation of the new kingdom proteoarchaeota. In: Genome Biology and Evolution, Band 7, Nr. 1, Januar 2015, S. 191–204; doi:10.1093/gbe/evu274, ResearchGate: 269819840, ePub: 19. Dezember 2014 (englisch).
- ↑ GTDB: Thermoproteota (phylum).
- ↑ Kerrin Mendler, Han Chen, Donovan H. Parks, Briallen Lobb, Laura A. Hug, Andrew C. Doxey: AnnoTree: visualization and exploration of a functionally annotated microbial tree of life. In: Nucleic Acids Research. 47. Jahrgang, Nr. 9, 21. Mai 2019, S. 4442–4448, doi:10.1093/nar/gkz246, PMID 31081040, PMC 6511854 (freier Volltext) – (englisch, annotree.uwaterloo.ca ( des vom 23. April 2021 im Internet Archive) [abgerufen am 26. Juli 2021]).
- ↑ NamesforLife: Thermoproteota corrig. Garrity and Holt 2021.
- ↑ Mark A. Kozubal, Margaret Romine, Ryan de Montmollin Jennings, Zack J. Jay, Susannah G. Tringe, Doug B. Rusch, Jacob P. Beam, Lee Ann McCue, William P. Inskeep: Geoarchaeota: a new candidate phylum in the Archaea from high-temperature acidic iron mats in Yellowstone National Park. In: ISME Journal, Band 7, Nr. 3, März 2013, S. 622–634; doi:10.1038/ismej.2012.132, PMC 3578567 (freier Volltext), PMID 23151644 (englisch).
- ↑ NCBI Taxonomy Browser: Candidatus Geoarchaeota (phylum), heterotypic synonym: NAG1, novel archaeal group I.
- ↑ NCBI Taxonomy Browser: Candidatus Marsarchaeota (phylum).
- ↑ Luke J. McKay, Mensur Dlakić, Matthew W. Fields, Tom O. Delmont, A. Murat Eren, Zackary J. Jay, Korinne B. Klingelsmith, Douglas B. Rusch, William P. Inskeep: Co-occurring genomic capacity for anaerobic methane and dissimilatory sulfur metabolisms discovered in the Korarchaeota. In: Nature Microbiology, Band 4, 4. März 2019, S. 614–622; doi:10.1038/s41564-019-0362-4 (englisch).
- ↑
'The All-Species Living Tree' Project (LTP, uib-csic.es):
- LTP: About. In: LTP. Abgerufen am 10. Mai 2025 (englisch).
- LTP_all tree in newick format. In: LTP. Abgerufen am 10. Mai 2023.
- LTP_06_2022 Release Notes. In: LTP. Abgerufen am 10. Mai 2023 (englisch).
- ↑
Genome Taxonomy Database (GTDB, gtdb.ecogenomic.org) Release 09-RS220
- GTDB: About Release 09-RS220. In: GTDB. Abgerufen am 10. Mai 2024 (englisch).
- ar53_r220.sp_label (Tree). In: GTDB. Abgerufen am 10. Mai 2024.
- Taxon History. In: GTDB. Abgerufen am 10. Mai 2024 (englisch).
- ↑ a b Jiawei Zhang, Xiaoyuan Feng, Meng Li, Yang Liu, Min Liu, Li-Jun Hou, Hong-Po Dong: Deep origin of eukaryotes outside Heimdallarchaeia within Asgardarchaeota. In: Nature, 7. Mai 2025; doi:10.1038/s41586-025-08955-7 (englisch). Siehe insbes. Ext. Data Fig. 1.
- ↑ a b Cymon J. Cox, Peter G. Foster, Robert P. Hirt, Simon R. Harris, T. Martin Embley: The archaebacterial origin of eukaryotes. In: Proc Natl Acad Sci USA. 105. Jahrgang, Nr. 51, 23. Dezember 2008, ResearchGate:23654817, S. 20356–20361, doi:10.1073/pnas.0810647105, PMID 19073919, PMC 2629343 (freier Volltext), bibcode:2008PNAS..10520356C (englisch).
- ↑ John M. Archibald: The eocyte hypothesis and the origin of eukaryotic cells. In: PNAS, Band 105. Nr. 51, 23. Dezember 2008, S. 20049–20050; doi:10.1073/pnas.0811118106, PMC 2629348 (freier Volltext), PMID 19091952 (englisch).
- ↑ Natalya Yutin, Eugene V. Koonin: The Dispersed Archaeal Eukaryome and the Complex Archaeal Ancestor of Eukaryotes. In: Cold Spring Harbor Perspectives in Biology. 6. Jahrgang, Nr. 4, April 2014, S. a016188, doi:10.1101/cshperspect.a016188, PMID 24691961, PMC 3970416 (freier Volltext) – (englisch).
- ↑ Elena Hilario, Johann Peter Gogarten: Horizontal transfer of ATPase genes--the tree of life becomes a net of life. In: Bio Systems. 31. Jahrgang, Nr. 2–3, 1993, PDF, S. 111–119, doi:10.1016/0303-2647(93)90038-E, PMID 8155843 (englisch).
- ↑
Gabriel Tarrason Risa, Fredrik Hurtig, Sian Bray, Anne E. Hafner, Lena Harker-Kirschneck, Peter Faull, Colin Davis, Dimitra Papatziamou, Delyan R. Mutavchiev, Catherine Fan, Leticia Meneguello, Andre Arashiro Pulschen, Gautam Dey, Siân Culley, Mairi Kilkenny, Diorge P. Souza, Luca Pellegrini, Robertus A. M. de Bruin, Ricardo Henriques, Ambrosius P. Snijders, Andela Šaric, Ann-Christin Lindås, Nicholas P. Robinson, Buzz Baum: The proteasome controls ESCRT-III–mediated cell division in an archaeon. In: Science, Band 369, Nr. 6504, 7. August 2020; doi:10.1126/science.aaz2532 (englisch). Siehe auch Proteasom; dazu:
- Evolutionary Insight: New Connection Discovered Between Primordial Organisms and Complex Life. Auf: SciTechDaily vom 28. August 2020, Quelle: Lancaster University.
- ↑ POLR2H Gene, alias: RPB8. Auf: GeneCards.
- ↑ Marta Kwapisz, Frédéric Beckouët, Pierre Thuriaux: Early evolution of eukaryotic DNA-dependent RNA polymerases. In: Trends in Genetics. 24. Jahrgang, Nr. 5, Mai 2008, S. 211–215, doi:10.1016/j.tig.2008.02.002, PMID 18384908 (englisch).
- ↑ a b
Laura Eme, Daniel Tamarit, Eva F. Cáceres, Courtney W. Stairs, Valerie De Anda, Max E. Schön, Kiley W. Seitz, Nina Dombrowski, William H. Lewis, Felix Homa, Jimmy H. Saw, Jonathan Lombard, Takuro Nunoura, Wen-Jun Li, Zheng-Shuang Hua, Lin-Xing Chen, Jillian F. Banfield, Emily St. John, Anna-Louise Reysenbach, Matthew B. Stott, Andreas Schramm, Kasper U. Kjeldsen, Andreas P. Teske, Brett J. Baker, Thijs J. G. Ettema: Inference and reconstruction of the heimdallarchaeial ancestry of eukaryotes. In: Nature, Band 618, S. 992–999; doi:10.1038/s41586-023-06186-2. Dazu:
- Nadja Podbregar: Wir sind alle „Asgardianer“ – Eukaryoten entstanden aus einer Untergruppe der Asgard-Archaeen. Auf: scinexx.de vom 26. Juni 2023.
- ↑ Eva F. Cáceres: Genomic and evolutionary exploration of Asgard archaea, Doktorarbeit, Universität Uppsala, Disciplinary Domain of Science and Technology, Biology, Department of Cell and Molecular Biology, 12. November 2019 (englisch).
- ↑ Katarzyna Zaremba-Niedzwiedzka, Eva F. Cáceres, Jimmy H. Saw, Disa Bäckström, Lina Juzokaite, Emmelien Vancaester, Kiley W. Seitz, Karthik Anantharaman, Piotr Starnawski, Kasper U. Kjeldsen, Matthew B. Stott, Takuro Nunoura, Jillian F. Banfield, Andreas Schramm, Brett J. Baker, Anja Spang, Thijs J. G. Ettema: Asgard archaea illuminate the origin of eukaryotic cellular complexity. In: Nature Band 541, 19. Januar 2017, S. 353–358; doi:10.1038/nature21031 (englisch).
- ↑ Bram Henneman: Histone-DNA assemblies in archaea: shaping the genome on the edge of life. Leiden University Repository, 4. Dezember 2019; hdl:1887/81191. Hier: Kapitel 1: Introduction (englisch). Siehe Fig. 1.1.
- ↑
Julian Vosseberg, Jolien J. E. van Hooff, Marina Marcet-Houben, Anne van Vlimmeren, Leny M. van Wijk, Toni Gabaldón, Berend Snel: Timing the origin of eukaryotic cellular complexity with ancient duplications. In: Nature Ecology & Evolution, Band 5, 26. Oktober 2020, S. 92–100; doi:10.1038/s41559-020-01320-z. Dazu:
- Timeline Unveiled for One of the Most Important and Puzzling Events in the Evolution of Life. Auf: SciTechDaily vom 4. November 2020, Quelle: Institute for Research in Biomedicine (IRB Barcelona) – ‚Bakterien‘ ist hier im Sinn von ‚Prokaryoten‘ zu verstehen.
- ↑ Culex Basin. Auf MapCarta (de).
- ↑ NCBI Taxonomy Browser: "Candidatus Odinarchaeum yellowstonii" Tamarit et al. 2022 (species), incl. "Candidatus Odinarchaeota" archaeon LCB_4, archaeon Odin LCB_4. Dazu: MAG: Candidatus Odinarchaeum yellowstonii isolate LCB_4, …
- ↑ UniProt: Taxonomy - Odinarchaeota yellowstonii (strain LCB_4) (species).
- ↑
Caner Akıl, Samson Ali, Linh T. Tran, Jérémie Gaillard, Wenfei Li, Kenichi Hayashida, Mika Hirose, Takayuki Kato, Atsunori Oshima, Kosuke Fujishima, Laurent Blanchoin, Akihiro Narita, Robert C. Robinson: Structure and dynamics of Odinarchaeota tubulin and the implications for eukaryotic microtubule evolution. In: Science Advances, Band 8, Nr. 12, 25. März 2022; doi:10.1126/sciadv.abm2225 (englisch). Dazu:
- Scientists discover potential key missing link protein bridging eukaryotes and prokaryotes. Auf: EurekAlert! vom 10. April 2022. Quelle: Tokyo Institute of Technology.
- ↑
Apoorv Verma, Emma Åberg-Zingmark, Tobias Sparrman, Ameeq Ul Mushtaq, Per Rogne, Christin Grundström, Ronnie Berntsson, Uwe H. Sauer, Lars Backman, Kwangho Nam, Elisabeth Sauer-Eriksson, Magnus Wolf-Watz: Insights into the evolution of enzymatic specificity and catalysis: From Asgard archaea to human adenylate kinases. In: Science Advances, Band 8, Nr. 44, eabm4089, 4. November 2022; doi:10.1126/sciadv.abm4089, PMID 36332013, PMC 9635829 (freier Volltext). Dazu:
- Sergio Postak: Human Enzyme Evolved from Ancient Single-Celled Organisms, Study Suggests. Auf Sci.News vom 7. November 2022.
- Anna Manz: Ur-Enzym mit besonderen Fähigkeiten entdeckt - Archaeen tragen urtümlichen Vorläufer eines auch für menschliche Zellen wichtigen Moleküls. Auf scinexx.de vom 2. Januar 2023.