Sporothrix schenckii
| Sporothrix schenckii | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Konidiophoren und Konidien von Sporothrix schenckii | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Sporothrix schenckii | ||||||||||||
| Hektoen & C. F. Perkins, 1900 |
Sporothrix schenckii ist ein weltweit vorkommender Pilz. Die Art ist nach Benjamin Schenck benannt ist, der ihn 1896 erstmals, noch als Medizinstudent, aus einem menschlichen Patienten isolierte.[1] Die Art kommt im Boden sowie in und auf lebendem und sich zersetzendem Pflanzenmaterial (z. B. Torfmoos) vor. Sie kann als Erreger der Sporotrichose (Rosengärtner-Krankheit, englisch rose handler’s disease) sowohl Menschen als auch Tiere infizieren.[2] Der häufigste Infektionsweg ist das Eindringen der Sporen in den Körper durch eine Schnitt- oder Stichwunde in der Haut. Die Infektion tritt häufig auch bei ansonsten gesunden Menschen auf; sie ist jedoch selten lebensbedrohlich und kann mit Antimykotika behandelt werden. Nichtparasitisch wächst dieser Pilz in Form von fadenförmigen Hyphen; parasitisch im Wirtsgewebe ist er in der Hefeform zu finden. Der Übergang zwischen der Hyphen- und der Hefeform ist temperaturbedingt, weshalb S. schenckii, als thermisch dimorpher Pilz klassifiziert wird.[1]
Morphologie

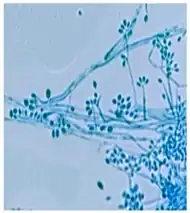

Sporothrix schenckii kann in einer von zwei Formen (Morphologien) vorkommen: als Hyphe oder als Hefe. Die Hyphenform findet sich in der Umwelt auf Pflanzen und verrottendem Material. Wenn der Pilz den Übergang zu einem tierischen oder menschlichen Wirt vollzieht, überwiegt (aufgrund dessen höherer Körpertemperatur) die Hefemorphologie.[1]
Hyphe
In der Umwelt oder im Labor bei 25 °C nimmt S. schenckii seine Hyphenform an.[5] Makroskopisch sind Fäden erkennbar; die Kolonien sind feucht, lederartig bis samtig und haben eine fein faltige Oberfläche. Die Farbe ist zunächst weiß und kann sich im Laufe der Zeit cremefarben bis dunkelbraun verfärben und ähnelt dann „schmutzigem Kerzenwachs“.[1] Mikroskopisch betrachtet sind die Hyphen septiert und haben einen Durchmesser von etwa 1 bis 2 μm. Die Konidien sind oval und sehen glasartig (hyalin) aus, farblos oder dunkel gefärbt. Die Gestalt der Konidien wird manchmal als blütenähnlich bezeichnet.[6]
Hefe
Bei 37 °C nimmt S. schenckii sowohl im Labor als auch im Wirtsgewebe seine Hefeform an. Makroskopisch gesehen wächst die Hefeform als glatte weiße oder cremefarbene Kolonie. Mikroskopisch sind die Hefezellen 2 bis 6 μm lang und zeigen eine längliche zigarrenförmige Gestalt.[1]
Epidemiologie und Risikofaktoren
S. schenckii ist weltweit verbreitet (kosmopolitisch).[1] In bestimmten Gebieten der Welt, darunter Peru, tritt die Krankheit jedoch häufiger auf.[7] Auf der Grundlage von Sequenzanalysen wurde festgestellt, dass Isolate von S. schenckii regionsabhängig in verschiedene phylogenetische Gruppen eingeordnet werden können.[8] S. schenckii wird häufig aus Pflanzen und dazugehörigem Verpackungsmaterial isoliert.[9] Gärtner,[10] Landschaftsgärtner[11] und Forstwirte[9] sind einem hohen Infektionsrisiko ausgesetzt. Eine Sporothrix-Infektion kann auch durch Katzenbisse oder -kratzer übertragen werden; dieser Übertragungsweg ist für Epidemien von Sporotrichose verantwortlich.[12] Immungeschwächte Personen haben ein erhöhtes Infektionsrisiko; solche Patienten weisen häufig schwerere Krankheitsverläufe auf.[13][14][15]
Sporotrichose

S. schenckii dringt am häufigsten durch kleine Verletzungen in den Körper ein, die die Hautbarriere beeinträchtigen.[13] Dieser Infektionsweg und das Vorkommen auf Rosen haben der Sporotrichose den Namen „Rosengärtner-Krankheit“ (englisch rose-handler’s disease oder rose thorn disease) eingebracht.[16][17]
Ein seltener Infektionsweg ist das Einatmen der Sporen und kommt hauptsächlich bei immungeschwächten Wirten vor.[18]
Kutane und lymphokutane Form
Die kutane Form (Hautform) der Erkrankung wird durch das Eindringen von S. schenckii in den Körper durch eine Störung der Hautbarriere (äußerliche Verletzung) verursacht.[13] Das erste Symptom der kutanen Sporotrichose ist eine kleine Hautläsion. Diese Läsionen können Ulzerationen und/oder Erytheme aufweisen.[1] In der Regel breitet sich die Infektion über die Lymphe entlang der Lymphgefäße aus und geht auf diese Weise über in die lymphokutane (Haut-Lymph-Form). Diese Form der Erkrankung ist durch das zusätzliche Auftreten von Läsionen an Stellen gekennzeichnet, die von der ursprünglichen Infektion weit entfernt sind.[1] Die Infektion kann beispielsweise bei (nichtmenschlichen) Tieren auftreten und dann durch Kontakt auf den Menschen übertragen werden (zoonotische Infektion/zoonotisches Spillover). Tierärzte sind daher einem besonders hohen Risiko ausgesetzt, sich bei Tieren anzustecken.[19]
Streuung
Eine disseminierte Erkrankung (gestreute Erkrankung, englisch disseminated disease) liegt vor, wenn sich der Pilz im gesamten Körper ausbreitet. Dies wurde nur bei immungeschwächten Patienten beobachtet und ist eine sehr schwere Erkrankung.[1][14][18] Bei einer disseminierten Infektion kann S. schenckii auch Gelenke, das Gehirn und die Wirbelsäule befallen.[1] Patienten mit dieser Erkrankung müssen aggressiv mit Antimykotika behandelt werden und müssen lebenslang prophylaktische Antimykotika erhalten, um ein Wiederauftreten oder eine Reinfektion zu verhindern.[13]
Diagnostische Tests
Makroskopisch zeigen sich Sporothrix-Infektionen nur mit unspezifischen Symptomen.[20] Im klinischen Labor werden viele in Kulturen isolierte Pilze als Verunreinigungen (Kontamination) betrachtet und außer Acht gelassen.[21] Daher ist eine genaue Patientenanamnese wichtig,[2] um den Verdacht auf Sporotrichose zu erhärten und um zu erfahren, welche diagnostischen Tests erforderlich sind.[1] Infektionen mit S. schenckii können leicht mit anderen Krankheiten wie Pyoderma gangraenosum[20] oder Sarkoidose[22] verwechselt werden, was die Notwendigkeit einer genauen Diagnose unterstreicht.
Primärkulturen
Die Anzucht des Pilzes in Reinkultur ist die zuverlässigste Methode zur Identifizierung einer Sporothrix-Infektion.[2] Ein Abstrich oder eine Biopsie des Patienten wird zur Beimpfung (Inokulation) von Sabouraud-Agar[18] oder Hirn-Herz-Infusionsbouillon (englisch Brain heart infusion, BHI[23]) verwendet.[16] Sabouraud-Agar wird bei Raumtemperatur bebrütet, um makroskopisch die weißliche bzw. dunkelbraune/schwarze Hyphenform des Pilzes und mikroskopisch die Hyphen und Konidien zu beobachten.[2][18] Die Hefeform wird auf der Hirn-Herz-Infusionsbouillon bei 37 °C gezüchtet.[16] Die Beobachtung von Hefekolonien zusätzlich zur Hyphenform ist erforderlich, um die Diagnose von S. schenckii zu bestätigen.[20] Das Wachstum auf Nährböden benötigt etwa ein bis drei Wochen, was bedeutet, dass die Ergebnisse von Patientenkulturen nicht sofort verfügbar sind, um Behandlungsentscheidungen zu treffen.[16]
Sporotrichin-Hauttest
Bei einem Hauttest wird ein aus im Labor gezüchteten S. schenckii gewonnenes Antigen verwendet, um das Immunsystem des Patienten herauszufordern. Das Antigen wird intrakutan injiziert und der Test wird 48 Stunden später ausgewertet. Ein Erythem (Hautrötung) an der Injektionsstelle zeigt eine positive Reaktion an.[1][16] Der Hauptvorteil dieses Tests ist seine Schnelligkeit und einfache Anwendung. Obwohl er schneller Ergebnisse liefert als eine Pilzkultur, hat der Sporotrichin-Hauttest einige wichtige Einschränkungen, denn es wurden Kreuzreaktionen mit anderen Pilzarten[24] sowie positive Reaktionen bei gesunden Personen[1] beobachtet. Im Übrigen bezeichnet der Begriff „Sporotrichin“ kein spezifisches Molekül, sondern nur von S. schenckii stammendes Antigen. Das spezifische bei Hauttests verwendete Antigen ist nicht standardisiert, und es wurden mehrere Studien mit sehr unterschiedlichen Präparaten durchgeführt. Aufgrund seiner Einfachheit bleibt der Hauttest dennoch die Methode der Wahl für groß angelegte epidemiologische Untersuchungen.[1]
Molekulare Methoden
Molekulare Diagnosetechniken wurden als schnelle, empfindliche und spezifische Tests für S. schenckii eingesetzt.[25] Es hat sich gezeigt, dass PCR-Methoden, die spezifisch das ribosomale RNA-Gen amplifizieren, S. schenckii in klinischen Proben mit minimaler Interferenz durch Wirts- oder Bakterien-Sequenzen nachweisen können.[26] Die Reaktivität von Serum-Antikörpern auf Antigene von S. schenckii kann auch durch ELISA quantifiziert werden.[27] Obwohl molekularbiologische Techniken als Diagnoseinstrumente vielversprechend sind, bedeuten ihre Kosten sowie der Bedarf an Spezialausrüstung und Fachwissen, dass traditionellere Diagnosemethoden bei der Behandlung von Sporothrix schenckii immer noch eine wichtige Rolle spielen.
Behandlung
Antimykotika
Sofern verfügbar und vom Patienten vertragen, sind antimykotische Medikamente als Erstbehandlung der Sporotrichose angezeigt. Bei kutaner Infektion sind Itraconazol oder Terbinafin die primäre Behandlung, wobei Fluconazol empfohlen wird, wenn die primären Antimykotika nicht gut vertragen werden. Wenn sich die Infektion im ganzen Körper ausgebreitet hat, ist Amphotericin B das Mittel der Wahl. Um den Pilz vollständig zu beseitigen, dauert die Behandlung in der Regel 3 bis 6 Monate.[13] Es hat sich gezeigt, dass die In-vitro-Empfindlichkeit gegenüber Antimykotika von der Wachstumsphase des Pilzes (Hyphen oder Hefen) abhängt.[28]
Kaliumjodid
Die orale Verabreichung einer gesättigten Kaliumjodidlösung war die erste wirksame Behandlung der Sporotrichose und ist in vielen Teilen der Welt aufgrund ihrer geringen Kosten und ihrer Verfügbarkeit nach wie vor das Mittel der Wahl.[29] Obwohl es wirksam ist, wurde es inzwischen durch antimykotische Medikamente verdrängt,[13] da mehrere Tagesdosen erforderlich sind und Nebenwirkungen wie Magen-Darm-Beschwerden oder Schilddrüsenstörungen auftreten können.[29]
Virulenzfaktoren
Melanin-Produktion
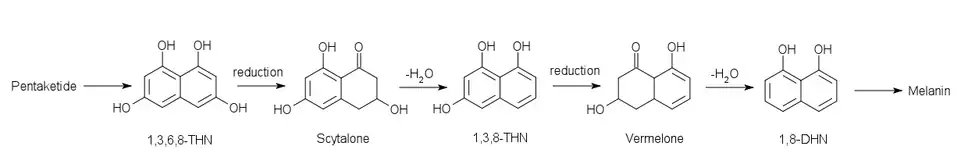
S. schenckii synthetisiert Melanin sowohl in vitro als auch in vivo[5] Die Melaninproduktion ist ein Virulenzfaktor, der bei vielen krankheitsverursachenden Pilzen zu finden ist.[30] Die Produktion von Melanin in S. schenckii schützt den Pilz vor oxidativem Stress sowie vor Ultraviolettstrahlung und der Abtötung durch Makrophagen. Das Melanin wird nachweislich über den 1,8-DHN-Pentaketid-Weg (siehe unten) synthetisiert.[5]
Adhesine
Das Anheften (Adhäsion) ist ein wichtiger Bestandteil der Entstehung und Entwicklung (Pathogenese) der Sporotrichose. Die Hefeform von S. schenckii zeigt eine erhöhte Fähigkeit zur Bindung an die extrazellulären Matrixproteine Fibronektin und Laminin des Wirts,[1] wobei sie zwei separate, für diese Proteine spezifische Rezeptoren nutzt.[32]
Proteasen
S. schenckii baut Proteine ab, indem der Pilz zwei verschiedene Proteasen produziert: eine Serinprotease und eine Asparaginprotease.[33] Diese Proteasen scheinen für das Wachstum des Pilzes wesentlich zu sein; dabei haben sie jedoch eine gewisse funktionelle Überschneidung: die Inaktivierung eines der beiden Proteine alleine beeinträchtigt das Wachstum nicht, jedoch wird der Pilz durch die Inaktivierung beider gehemmt.[34] Die Proteaseaktivität hat sich bei der In-vivo-Infektion von Mäusen als wichtig erwiesen.[33] Zu den Substraten für diese Proteasen gehören die Hautproteine Typ-I-Kollagen, Stratum corneum und Elastin.[33]
Hitzetoleranz
Das Wachstum bei Körpertemperatur des Wirts (37 °C) ist eine wichtige Voraussetzung für die Pathogenese. Allerdings können einige Stämme von S. schenckii nur bei niedrigeren Temperaturen um 35 °C wachsen und verursachen daher in der Regel nur Krankheiten auf der Haut, da diese kühler ist als das Körperinnere. Die anderen Stämme, die bei Körpertemperatur wachsen können, sind dagegen häufiger mit disseminierten Erkrankungen verbunden.[33]
Immunreaktion
Die Infektion mit S. schenckii ist bei immunkompetenten Wirten (mit intaktem Immunsystem) im Allgemeinen selbstlimitierend. Die Immunreaktion verhindert die Ausbreitung des Pilzes und ist der Grund dafür, dass die meisten Sporothrix-Infektionen kutan verlaufen.[35]
Angeborene Immunreaktion
Die Hefeform von S. schenckii wird von Zellen des angeborenen Immunsystems[35] effektiv phagozytiert und aufgrund der Zuckermoleküle auf ihrer Oberfläche[36] oder der Lipide in der Hefezellmembran[35] erkannt. Problem: Obwohl sie aufgenommen werden, werden sie nicht effizient abgetötet.[35] S. schenckii ist auch in der Lage, die Immunantwort zu modulieren (schwächen), indem es die Zytokinproduktion durch Makrophagen blockiert, wodurch sein eigenes Überleben gefördert wird.[35]
Spezifische Immunreaktion
Die spezifische Immunreaktion ist erst im späteren Verlauf der Infektion aktiv und umfasst sowohl B-Zellen als auch T-Zellen. Schwere Sporotrichose ist in endemischen Gebieten, in denen der Mensch nahezu ständig mit Sporen von S. schenckii in Kontakt kommt, selten. Diese Tatsache in Verbindung mit dem erhöhten Schweregrad der Erkrankung bei immungeschwächten Patienten deutet darauf hin, dass die spezifische Immunität bei der Infektion mit S. schenckii eine wichtige Rolle spielt.[35] Es wurde nachgewiesen, dass Patienten mit Sporotrichose spezifische Antikörper gegen S. schenckii bilden,[37] und diese Antikörper können sogar schützend gegen die Krankheit wirken.[1]
Weiterführende Literatur
- Tom Volk: Tom Volk's Fungus of the Month for February 2003. This month's fungus is Sporothrix schenckii, cause of Rose-picker's Disease (botany.wisc.edu).
- Nelson Ivan Agudelo Higuita: Sporotrichosis. Auf Medscape.
- David Ellis: Sporothrix schenckii complex. University of Adelaide: Mycology Online (mycology.adelaide.edu.au). Memento im Webarchiv vom 26. November 2016.
- Mônica Bastos de Lima Barros mblbarros@fiocruz.br, Rodrigo de Almeida Paes, Armando Oliveira Schubach: Sporothrix schenckii and Sporotrichosis. In: ASM Journals: Clinical Microbiology Reviews, Band 24, Nr. 4, 1. Oktober 2011, doi:10.1128/cmr.00007-11 (englisch).
- Whitney Johnson: Sporothrix schenckii. Auf: MicrobeWiki. Stand: 20. August 2010. Rechte bei Rachel Larsen. Kenyon College, Department of Biology.
- Michaela Maya-Mrschtik: Unwahrscheinlich tödlich: Tod durch Dornbusch. Auf: spektrum.de vom 2. Juli 3024.
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p Mônica Bastos de Lima Barros, Rodrigo de Almeida Paes, Armando Oliveira Schubach: Sporothrix schenckii and Sporotrichosis. In: Clinical Microbiology Reviews, Band 24, Nr. 4, Oktober 2011, S. 633–654; doi:10.1128/cmr.00007-11, PMC 3194828 (freier Volltext), PMID 21976602 (englisch).
- ↑ a b c d Elsa Vásquez-del-Mercado, Roberto Arenas, Carmen Padilla-Desgarenes: Sporotrichosis. In: Clinics in Dermatology. 30. Jahrgang, Nr. 4, Juli 2012, S. 437–443, doi:10.1016/j.clindermatol.2011.09.017, PMID 22682194 (englisch).
- ↑ Jorge Rodriguez-Caban, Waleska Gonzalez-Velazquez, Lizaida Perez-Sanchez, Ricardo Gonzalez-Mendez, Nuri Rodriguez-del Valle: Calcium/calmodulin kinase1 and its relation to thermotolerance and HSP90 in Sporothrix schenckii: an RNAi and yeast two-hybrid study. In: BMC Microbiolohy. Band 11, 11. Juli 2011, S. 162; doi:10.1186/1471-2180-11-162, PMC 3146815 (freier Volltext), PMID 21745372 (englisch).
- ↑ Marcos S. Toledo, Loriane Tagliari, Erika Suzuki, Claudinei M. Silva, Anita H. Straus, Helio K. Takahashi: Effect of anti-glycosphingolipid monoclonal antibodies in pathogenic fungal growth and differentiation. Characterization of monoclonal antibody MEST-3 directed to Manpalpα1→3Manpα1→2IPC. In: BMC Microbiology, Band 10, 15. Februar 2010, S. 47; doi:10.1186/1471-2180-10-47, PMC 2831884 (freier Volltext), PMID 20156351 (englisch).
- ↑ a b c Rachael Morris-Jones, Sirida Youngchim, Beatriz L. Gomez, Phil Aisen, Roderick J. Hay, Joshua D. Nosanchuk, Arturo Casadevall, Andrew J. Hamilton: Synthesis of melanin-like pigments by Sporothrix schenckii in vitro and during mammalian infection. In: Infection and Immunity, Band 71, Nr. 7, Juli 2003, S. 4026–4033; doi:10.1128/iai.71.7.4026-4033.2003, PMC 161969 (freier Volltext), PMID 12819091 (englisch).
- ↑ Sporothrix schenckii complex. Auf: Mycology Online - University of Adelaide (mycology.adelaide.edu.au). Memento im Webarchiv vom 26. November 2016 (englisch).
- ↑ Peter G. Pappas, Ildefonso Tellez, Alexandria E. Deep, Delia Nolasco, Walter Holgado, Beatriz Bustamante: Sporotrichosis in Peru: description of an area of hyperendemicity. In: Clinical Infectious Diseases. 30. Jahrgang, Nr. 1, Januar 2000, S. 65–70, doi:10.1086/313607, PMID 10619735 (englisch).
- ↑ Rita Marimon, Josepa Gené, Josep Cano, Luciana Trilles, Márcia Dos Santos Lazéra, Josep Guarro: Molecular phylogeny of Sporothrix schenckii. In: Journal of Clinical Microbiology, Band 44, Nr. 9, September 2006, S. 3251–3256; doi:10.1128/jcm.00081-06, PMC 1594699 (freier Volltext), PMID 16954256 (englisch).
- ↑ a b Dennis M. Dixon, Ira F. Salkin, Rory A. Duncan, Nancy J. Hurd, John H. Haines, Maggi E. Kemna, F. Bruce Coles: Isolation and characterization of Sporothrix schenckii from clinical and environmental sources associated with the largest U.S. epidemic of sporotrichosis. In: Journal of Clinical Microbiology, Band 29, Nr. 6, Juni 1991, S. 1106–1113; doi:10.1128/jcm.29.6.1106-1113.1991, PMC 269953 (freier Volltext), PMID 1864926 (englisch).
- ↑ Centers for Disease Control & Prevention (CDC): Sporotrichosis Associated with Wisconsin Sphagnum Moss. In: Morbidity and Mortality Weekly Report. 31. Jahrgang, Nr. 40, 15. Oktober 1982, S. 542–544, PMID 6817054, JSTOR:45195044 (englisch).
- ↑ Centers for Disease Control (CDC): Multistate outbreak of sporotrichosis in seedling handlers, 1988. In: Morbidity and Mortality Weekly Report. 37. Jahrgang, Nr. 42, Oktober 1988, S. 652–653, PMID 2971870 (englisch). Sowie in JAMA, Band 260, Nr. 1, 18. November 1988, S. 2806–2811; doi:10.1001/jama.1988.03410190050012 (englisch).
- ↑ Mônica Bastos de Lima Barros, Armando de Oliveira Schubach, Antônio Carlos Francesconi do Valle, Maria Clara Gutierrez Galhardo, Fátima Conceição-Silva, Tânia Maria Pacheco Schubach, Rosani Santos Reis, Bodo Wanke, Keyla Belizia Feldman Marzochi, Maria José Conceição: Cat-transmitted sporotrichosis epidemic in Rio de Janeiro, Brazil: description of a series of cases. In: Clinical Infectious Diseases. 38. Jahrgang, Nr. 4, Februar 2004, S. 529–535, doi:10.1086/381200, PMID 14765346 (englisch).
- ↑ a b c d e f Carol A. Kauffman, Beatriz Bustamante, Stanley W. Chapman, Peter G. Pappas: Clinical practice guidelines for the management of sporotrichosis: 2007 update by the Infectious Diseases Society of America. In: Clinical Infectious Diseases. 45. Jahrgang, Nr. 10, November 2007, S. 1255–1265, doi:10.1086/522765, PMID 17968818 (englisch).
- ↑ a b Jaffar A. Al-Tawfiq, Kara K. Wools: Disseminated sporotrichosis and Sporothrix schenckii fungemia as the initial presentation of human immunodeficiency virus infection. In: Clinical Infectious Diseases, Band 26, Nr. 6, Juni 1998, S 1403–1406; doi:10.1086/516356, PMID 9636870 (englisch).
- ↑ Maria Clara Gutierrez Galhardo, Marcus Tulius T. Silva, Marco Antonio Lima, Estevão Portela Nunes, Luiz Eduardo C. Schettini, Rodrigo Fernandes de Freitas, Rodrigo de Almeida Paes, Elizabeth de Sousa Neves, Antonio Carlos, Francesconi do Valle. Sporothrix schenckii meningitis in AIDS during immune reconstitution syndrome. In: Journal of Neurology, Neurosurgery & Psychiatry, Band 81, Nr. 6, Juni 2010, S. 696–699; doi:10.1136/jnnp.2009.173187, PMID 20392979 (englisch).
- ↑ a b c d e Sporotrichosis: Rose Handler’s Disease (PDF; 0,3 MB). Auf: Iowa State University (iastate.edu). Stand: Februar 2017 (englisch).
- ↑ Mary Peterson: Sporotrichosis: aka The Rose Thorn Disease (PDF). Auf: American Rose Society (ars.org). Memento im Webarchiv vom 26. Juni 2013 (englisch).
- ↑ a b c d
Nelson Ivan Agudelo Higuita; Francisco Talavera, Thomas M. Kerkering (Editor): Sporotrichosis. Auf: Medscpe emedicine (emedicine.medscape.com). Stand: 18. Dezember 2024 (englisch). Hier:
- Scott D. Miller; Richard P. Vinson, Lester F. Libow, Dirk M. Elston (Editor): Dermatologic Manifestations of Sporotrichosis Workup. Memento im Webarchiv vom 30. Mai 2016.
- ↑ Ronald D. Welsh: Sporotrichosis. In: Journal of the American Veterinary Medical Association. 223. Jahrgang, Nr. 8. AVMA, Oktober 2003, S. 1123–1126, doi:10.2460/javma.2003.223.1123, PMID 14584741 (englisch).
- ↑ a b c
Sporothrix Species. Auf: Doctor Fungus (drfungus.org). Hier:
- Sporothrix spp. Auf: Doctor Fungus (doctorfungus.org). Memento im Webarchiv vom 18. März 2015 (englisch).
- ↑ Ronen Ben-Ami, Russell E. Lewis, Issam I. Raad, Dimitrios P. Kontoyiannis: Phaeohyphomycosis in a tertiary care cancer center. In: Clinical Infectious Diseases. 48. Jahrgang, Nr. 8, April 2009, S. 1033–1041, doi:10.1086/597400, PMID 19267655 (englisch).
- ↑ M. F. B. Singh, Sandra Regina M. Fernandes, Adil Muhib Samara: Sporothrix schenckii infection mimicking sarcoidosis. In: Rheumatology, Band 43, Nr. 2, Februar 2004, S. 248–249; doi:10.1093/rheumatology/keh010, PMID 14739470 (englisch).
- ↑ Hirn-Herz-Bouillon, BHI-Bouillon, Hirn-Herz-Infusionsbouillon. Auf: Merck Sigma-Aldrich (sigmaaldrich.com).
- ↑ Hiroshi Ishizaki, Yoichi Nakamura, Hideo Kariya, Tokio Iwatsu, Robert W. Wheat: Delayed hypersensitivity cross-reactions between Sporothrix schenckii and Ceratocystis species in sporotrichotic patients. In: Journal of Clinical Microbiology. 3. Jahrgang, Nr. 6, 1. Juni 1976, S. 545–547, doi:10.1128/jcm.3.6.545-547.1976, PMID 59734, PMC 274353 (freier Volltext) – (englisch).
- ↑ Simon D. Atkins, Ian Michael Clark: Fungal molecular diagnostics: a mini review. In: Journal of Applied Genetics. 45. Jahrgang, Nr. 1, Februar 2004, ResearchGate:8694377, S. 3–15, PMID 14960763 (englisch).
- ↑ Sindy Hu, Wen-Hung Chung, Shuen-Iu Hung, Hsin-Chun Ho, Zen-Whe Wang, Chien-Hsun Chen, Shu-Chuan Lu, Tseng-tong Kuo, Hong-Shang Hong: Detection of Sporothrix schenckii in clinical samples by a nested PCR assay. In: Journal of Clinical Microbiology, Band 41, Nr. 4, April 2003, S. 1414–1418; doi:10.1128/jcm.41.4.1414-1418.2003, PMC 153868 (freier Volltext), PMID 12682123 (englisch).
- ↑ Rodrigo Almeida-Paes, Monique A. Pimenta, Claudia Vera Pizzini, Paulo Cezar F. Monteiro, José Mauro Peralta, Joshua D. Nosanchuk, Rosely Maria Zancopé-Oliveira: Use of Mycelial-Phase Sporothrix schenckii Exoantigens in an Enzyme-Linked Immunosorbent Assay for Diagnosis of Sporotrichosis by Antibody Detection. In: Clinical and Vaccine Immunology, Band 14, Nr. 3, März 2007, S. 244–249; doi:10.1128/cvi.00430-06, PMC 1828849 (freier Volltext), PMID 17215334 (englisch).
- ↑ Luciana Trilles, Belkys Fernández-Torres, Márcia dos Santos Lazéra, Bodo Wanke, Armando de Oliveira Schubach, Rodrigo de Almeida Paes, Isabel Inza, Josep Guarro: In vitro antifungal susceptibilities of Sporothrix schenckii in two growth phases. In: Antimicrobial Agents and Chemotherapy, Band 49, Nr. 9, September 2005, S. 3952–3954; doi:10.1128/aac.49.9.3952-3954.2005, PMC 1195444 (freier Volltext), PMID 16127080 (englisch).
- ↑ a b J. Barton Sterling, Warren R. Heymann: Potassium iodide in dermatology: a 19th century drug for the 21st century-uses, pharmacology, adverse effects, and contraindications. In: Journal of the American Academy of Dermatology. 43. Jahrgang, Nr. 4, Oktober 2000, S. 691–697, doi:10.1067/mjd.2000.107247, PMID 11004629 (englisch).
- ↑ Sanjay G. Revankar, Deanna A. Sutton: Melanized fungi in human disease. In: Clinical Microbiology Reviews. 23. Jahrgang, Nr. 4, Oktober 2010, S. 884–928, doi:10.1128/cmr.00019-10, PMID 20930077, PMC 2952981 (freier Volltext) – (englisch).
- ↑ Rafael Romero-Martinez, Michael Wheeler, Antonieta Guerrero-Plata, Guadalupe Rico, Haydée Torres-Guerrero: Biosynthesis and functions of melanin in Sporothrix schenckii. In: Infection and Immunity, Band 68, Nr. 6, Juni 2000, S. 3696–3703; doi:10.1128/iai.68.6.3696-3703.2000, PMC 97661 (freier Volltext), PMID 10816530 (englisch).
- ↑ Osana C. Lima, Jean-Philippe Bouchara, Gilles Renier, Agnes Marot-Leblond, Dominique Chabasse, Leila M. Lopes-Bezerra: Immunofluorescence and flow cytometry analysis of fibronectin and laminin binding to Sporothrix schenckii yeast cells and conidia. In: Microbial Pathogenesis, Band 37, Nr. 3, September 2004, S. 131–140; doi:10.1016/j.micpath.2004.06.005, PMID 15351036 (englisch).
- ↑ a b c d Laura H. Hogan, Bruce S. Klein, Stuart M. Levitz: Virulence factors of medically important fungi. In: Clinical Microbiology Reviews. 9. Jahrgang, Nr. 4, Oktober 1996, S. 469–488, doi:10.1128/CMR.9.4.469, PMID 8894347, PMC 172905 (freier Volltext) – (englisch).
- ↑ Ryoji Tsuboi, Taeko Sanada, Hideoki Ogawa: Influence of culture medium pH and proteinase inhibitors on extracellular proteinase activity and cell growth of Sporothrix schenckii. In: Journal of Clinical Microbiology. 26. Jahrgang, Nr. 7, Juli 1988, S. 1431–1433, doi:10.1128/jcm.26.7.1431-1433.1988, PMID 3045155, PMC 266631 (freier Volltext) – (englisch).
- ↑ a b c d e f Iracilda Zeppone Carlos, Micheli Fernanda Sassá, Diana Bridon da Graça Sgarbi, Marisa Campos Polesi Placeres, Danielle Cardoso Geraldo Maia: Current research on the immune response to experimental sporotrichosis. In: Mycopathologia. 168. Jahrgang, Nr. 1, Juli 2009, S. 1–10, doi:10.1007/s11046-009-9190-z, PMID 19241140 (englisch).
- ↑ L. M. Oda, Claire F. Kubelka, Celuta Sales Alviano, Luiz R Travassos: Ingestion of yeast forms of Sporothrix schenckii by mouse peritoneal macrophages. In: Infection and Immunity, Band 39, Nr. 2, Februar 1983, S. 497–504; doi:10.1128/iai.39.2.497-504.1983, PMC 347978 (freier Volltext), PMID 6832808 (englisch).
- ↑ E. Nan Scott, Harold G. Muchmore: Immunoblot analysis of antibody responses to Sporothrix schenckii. In: Journal of Clinical Microbiology. 27. Jahrgang, Nr. 2, Februar 1989, ResearchGate:20241282, S. 300–304, doi:10.1128/jcm.27.2.300-304.1989, PMID 2915023, PMC 267296 (freier Volltext) – (englisch).