Silene (Stoffgruppe)
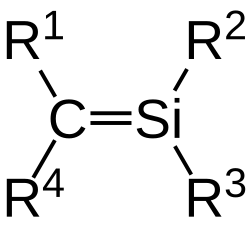
Silene oder Silaethene sind eine Stoffgruppe aus der siliciumorganischen Chemie. Sie besitzen eine Kohlenstoff-Silicium-Doppelbindung und entsprechen damit Alkenen, bei denen eines der beiden Kohlenstoffatomen durch Silicium ersetzt ist. Strukturell verwandt sind die Disilene, bei denen beide Atome in der Doppelbindung Silicium sind.
Geschichte
Erste Hinweise auf die Existenz von Silenen wurden 1966 gefunden. Es konnte durch spektroskopische Untersuchungen nachgewiesen werden, dass bei der Pyrolyse von Silacyclobutanen Silene als reaktive Zwischenstufen entstehen, die dann weiter zu 1,3-Disilacyclobutanen reagieren.[1][2]
Das erste stabile Silen wurde 1981 von Adrian Gibbs Brook synthetisiert. Es handelt sich um ein Silen, bei dem am Kohlenstoffatom der Doppelbindung eine Trimethylsiloxy- und eine sterisch anspruchsvolle Adamantyl-Gruppe gebunden sind.[3] Nach ihm werden Silene, die eine Siloxygruppe am Kohlenstoffatom aufweisen, auch Brook-Silene genannt.[4] Schließlich konnte 1985 auch das erste stabile Silen ohne stabilisierende Siloxygruppe synthetisiert werden.[5]
Bindung
Die Bindungslänge einer Kohlenstoff-Silicium-Doppelbindung hängt von den an die Doppelbindung gebundenen Liganden ab. Ist kein π-Donor-Substituent wie etwa Sauerstoff oder eine Siloxygruppe an den Kohlenstoff gebunden, beträgt die Bindungslänge etwa 170 pm. Gegenüber einer typischen Silicium-Kohlenstoff-Einzelbindung von 187 pm ist die Doppelbindung etwa 17 pm kürzer.[5] Dies ist ähnlich der Bindungsverhältnisse beim Kohlenstoff, bei dem es ebenfalls eine Bindungsverkürzung von Alkanen (153 pm) zu Alkenen (134 pm) gibt.[6]
Auf Grund der unterschiedlichen Elektronegativitäten von Kohlenstoff und Silicium sind Bindungen dieser Elemente polarisiert. Dabei ist der elektronegativere Kohlenstoff negativ, Silicium positiv polarisiert. Diese Polarisierung dreht sich jedoch zu einem partiell positiv geladenen Kohlenstoffatom um, wenn stark elektronegative π-Donor-Substituenten am Kohlenstoff gebunden sind. Effekte, die diese Polarisationsumkehr bewirken sind eine Verringerung des Doppelbindungscharakters, eine größere Stabilität, geringere Reaktivität und Verlängerung der Bindungslänge. So beträgt die Bindungslänge eines Brook-Silens 176 pm.[2][7]
Bei den Silenoaten, den Silen-Äquivalenten der Enole wurde festgestellt, dass die Bindungslänge 193 pm beträgt. Zudem ist die Kohlenstoff-Sauerstoff-Bindungslänge im Silenoat mit 124,5 pm ähnlich der einer Carbonylverbindung. Dies bedeutet, dass die Keto-Enol-Tautomerie bei Silenoaten sehr stark auf der Seite des Ketons liegt.[8]
Gewinnung und Darstellung
Die Darstellung von Brook-Silenen erfolgt in zwei Stufen. Zunächst wird ein Carbonsäurechlorid mit einem Silylanion umgesetzt. Das entstandene Acylsilan reagiert durch thermische oder photolytische Umlagerung zum Silen.[9]
Nicht durch Sauerstoff stabilisierte Silene lassen sich durch Salzeliminierung darstellen. Dazu wird ein halogeniertes Carbosilan durch Reaktion mit Butyllithium lithiiert und anschließend durch geeignete Reaktionen, etwa die Umsetzung mit Trimethylsilylchlorid, Lithiumchlorid eliminiert und die Doppelbindung gebildet.[5][10]
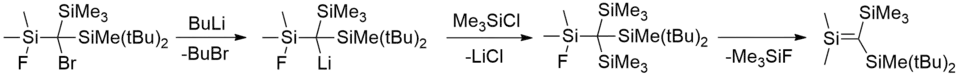
Eine weitere Möglichkeit für die Synthese von Silenen ist eine sila-Peterson-Olefinierung, eine Reaktion von Carbonylverbindungen mit siylierten Silylanionen.[11]
Eigenschaften
Silene neigen zur Dimerisierung unter Bildung von Disilacyclobutanen. Dabei beeinflussen die Substituenten am Silen und die Polarisierung, wie stark es zur Dimerisierung neigt und ob eher 1,2- oder 1,3-Disilacyclobutane entstehen. Silene mit kleineren Substituenten dimerisieren stärker und leichter als solche mit großen Substituenten. Diese Reaktion ist bei vielen Silenen so schnell, dass das viele Silene nur unter speziellen Bedingungen, etwa in der Argonmatrix, isolierbar sind. Erst mit einer sterischen Hinderung wird die Doppelbindung stabilisiert und die Dimerisierung verhindert.[12][13]
Wie Alkene reagieren Silene mit Wasser, Alkoholen, Aminen und anderen Nucleophilen unter Elektrophiler Addition. Bei dieser Reaktion reagiert normalerweise das Siliciumatom mit dem Nucleophil, es bilden sich Silanole, Silylether oder Silylamine. Eine Addition an das Kohlenstoffatom wurde nur in wenigen Fällen, etwa bei einem 4-Silatriafulven[11] oder einem 1-Silaallen[14] beobachtet. Die Polarisierung der Silicium-Kohlenstoff-Bindung beeinflusst die Reaktionsgeschwindigkeit der Addition. Normal polarisierte Silene reagieren schneller als invers polarisierte.[12]
Typische Reaktionen von Silenen mit Alkenen und Dienen sind [2+2]-Cycloadditionen, [2+4]-Cycloadditionen (Diels-Alder-Reaktionen) und En-Reaktionen. Dabei werden die stufenweise ablaufenden [2+2]-Cycloadditionen bei Silenen deutlich häufiger beobachtet als bei Alkenen. Es sind auch Diene bekannt, die mit Silenen in einer [2+2]-Cycloaddition reagieren, während bei Reaktionen von Dienen mit Alkenen Diels-Alder-Reaktionen stark bevorzugt ablaufen. Auch Carbonylverbindungen und Imine reagieren mit Silenen unter [2+2]- und [2+4]-Cycloadditionen. Letztere sind unter Einbeziehung eines aromatischen Restes an der Carbonylverbindung oder dem Silen möglich.[13]
Weitere Silene
Es ist ein cyclisches Silen in Form eines Vierrings mit zwei Silicium- einem Sauerstoff- und einem Kohlenstoffatom bekannt. Dies entsteht bei der Reaktion von lithiierten Disilenen mit Carbonsäurechloriden. Dabei entsteht kein, wie als Ableitung aus der Kohlenstoffchemie erwartbares, Acyldisilen, sondern es erfolgt eine Cyclisierung.[9]
Es sind aromatische Silene bekannt. Diese sind jedoch sehr instabil und lassen sich nur schwierig isolieren. Die Stammverbindung Silabenzol[S 1] konnte durch Blitzthermolyse von 1-Sila-2,5-cyclohexadien synthetisiert und durch Matrixisolation untersucht werden.[15] Auch Silacyclopentadiene sind bekannt.[16]
Einzelnachweise
- ↑ L. E. Gusel’nikov, M. C. Flowers: The thermal decomposition of 1,1-dimethyl-1-silacyclobutane and some reactions of an unstable intermediate containing a silicon–carbon double bond. In: Chemical Communications. 1967, Nummer 17, S. 864–865, doi:10.1039/C19670000864.
- ↑ a b Christoph Elschenbroich: Organometallchemie. 6. Auflage, Teubner, 2008, ISBN 978-3-8351-0167-8, S. 151–155.
- ↑ A. G. Brook, Fereydon Abdesaken, Brigitte Gutekunst, G. Gutekunst, R. Krishna Mohan Rao Kallury: A solid silaethene: isolation and characterization. In: Journal of the Chemical Society Chemical Communications. 1981, Nummer 4, S. 191, doi:10.1039/C39810000191.
- ↑ Kim M. Baines: Brook silenes: inspiration for a generation. In: Chemical Communications. 2013, Band 49, Nummer 57, S. 6366, doi:10.1039/C3CC42595A.
- ↑ a b c Nils Wiberg, Gerhard Wagner, Gerhard Müller: Isolierung und Struktur eines stabilen Moleküls mit Silicium-Kohlenstoff-Doppelbindung. In: Angewandte Chemie. 1985, Band 97, Nummer 3, S. 220–222, doi:10.1002/ange.19850970318.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 888.
- ↑ Henrik Ottosson, Patrick G. Steel: Silylenes, Silenes, and Disilenes: Novel Silicon‐Based Reagents for Organic Synthesis?. In: Chemistry – A European Journal. 2005, Band 12, Nummer 6, S. 1576–1585, doi:10.1002/chem.200500429.
- ↑ Tamaz Guliashvili, Ibrahim El Tantawy El Sayed, Andreas Fischer, Henrik Ottosson: The First Isolable 2‐Silenolate. In: Angewandte Chemie. 2003, Band 115, Nummer 14, S. 1678–1680, doi:10.1002/ange.200250400.
- ↑ a b Iulia Bejan, Denis Güclü, Shigeyoshi Inoue, Masaaki Ichinohe, Akira Sekiguchi, David Scheschkewitz: Stabile cyclische Silene durch Reaktion von Disileniden mit Carbonsäurechloriden. In: Angewandte Chemie. 2007, Band 119, Nummer 18, S. 3413–3416, doi:10.1002/ange.200700067.
- ↑ Nils Wiberg, Gerhard Preiner: Darstellung und einige Reaktionen von 1,1‐Dimethyl‐2,2‐bis(trimethylsilyl)‐1‐silaethen. In: Angewandte Chemie. 1977, Band 89, Nummer 5, S. 343–344, doi:10.1002/ange.19770890528.
- ↑ a b Kenkichi Sakamoto, Jun Ogasawara, Yoshihiro Kon, Tatsuya Sunagawa, Chizuko Kabuto, Mitsuo Kira: The First Isolable 4-Silatriafulvene In: Angewandte Chemie. 2002, Band 114, Nummer 8, S. 1460, doi:10.1002/1521-3757(20020415)114:8<1460::AID-ANGE1460>3.0.CO;2-C.
- ↑ a b Henrik Ottosson, Anders M. Eklöf: Silenes: Connectors between classical alkenes and nonclassical heavy alkenes. In: Coordination Chemistry Reviews. 2007, Band 252, Nummer 12–14, S. 1287–1314, doi:10.1016/j.ccr.2007.07.005.
- ↑ a b A. G. Brook, Michael A. Brook: The Chemistry of Silenes. In: Advances in organometallic chemistry. 1996, S. 71–158, doi:10.1016/S0065-3055(08)60466-9.
- ↑ Masaaki Ichinohe, Takashi Tanaka, Akira Sekiguchi: Photoisomerization of Persilyl-Substituted Silacyclopropene: Formation of Stable Persilyl-Substituted 1-Silaallene, and Its Reactivity. In: Chemistry Letters. 2001, Band 30, Nummer 11, S. 1074–1075, doi:10.1246/cl.2001.1074.
- ↑ Günther Maier, Gerhard Mihm, Hans Peter Reisenauer: Thermische Dehydrierung von 1‐Sila‐2,5‐cyclohexadien zu Silabenzol. In: Chemische Berichte. 1982, Band 115, Nummer 2, S. 801–803, doi:10.1002/cber.19821150243.
- ↑ William H. Atwell, Donald R. Weyenberg, Henry Gilman: Silacyclopentadiene chemistry. I. 1,1-dimethyl-2,5-diphenyl-1-silacyclopentadiene. In: The Journal of Organic Chemistry. 1967, Band 32, Nummer 4, S. 885–888, doi:10.1021/jo01279a007.