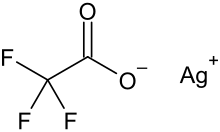
Silbertrifluoracetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Silbertrifluoracetat | |||||||||||||||
| Summenformel | C2AgF3O2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 220,88 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Silbertrifluoracetat ist eine organische Verbindung aus der Gruppe der Trifluoracetate, das Silbersalz der Trifluoressigsäure.
Herstellung
Silbertrifluoracetat kann durch Reaktion von Trifluoressigsäure mit Silber(I)-oxid in Diethylether gewonnen werden.[2]
Reaktionen
Die Reaktion von Silbertrifluoracetat mit Nitrosylchlorid ergibt das gemische Anhydrid Nitrosyltrifluoracetat, dessen Pyrolyse unter Abspaltung von Kohlenstoffdioxid zu Trifluornitrosomethan führt.[3] Durch Reaktion Iodbenzoldichlorid wird (Bis(trifluoracetoxy)iod)benzol erhalten, das als Reagenz in der organischen Synthese verwendet wird, beispielsweise für Dehydratisierungen.[4]
Die Reaktion von Silbertrifluoracetat mit Carbonsäurechloriden (zum Beispiel Benzoylchlorid) ergibt gemischte Anhydride der Trifluoressigsäure (zum Beispiel Benzoyltrifluoracetat).[5] Mit elementarem Iod oder Brom bilden sich Reagenzien, die Aromaten bromieren beziehungsweise iodieren können. So entsteht aus Benzol als Hauptprodukt Iodbenzol beziehungsweise Brombenzol, aus Iodbenzol 1,4-Diiodbenzol oder 1-Brom-4-iodbenzol, aus Brombenzol 1-Brom-4-iodbenzol oder 1,4-Dibrombenzol. Bei der Reaktion von Silbertrifluoracetat mit Iod in Nitrobenzol wird dieses hingegen kaum iodiert, stattdessen entsteht vor allem Trifluoriodmethan.[6]
Durch Salzmetathese mit diversen Metallchloriden können andere Trifluoracetate gewonnen werden, zum Beispiel Zinktrifluoracetat aus Zinkchlorid.[7]
Einzelnachweise
- ↑ a b c d Eintrag zu Silber(I)-Trifluoracetate, >98.0% bei TCI Europe, abgerufen am 12. Mai 2025.
- ↑ James Traynham, John Dehn: Notes - Reaction of Silver Trifluoroacetate with Some Alkyl Halides. In: The Journal of Organic Chemistry. Band 23, Nr. 10, Oktober 1958, S. 1545–1546, doi:10.1021/jo01104a039.
- ↑ C. W. Taylor, T. J. Brice, R. L. Wear: The Preparation of Polyfluoronitrosoalkanes from Nitrosyl Polyfluoroacylates. In: The Journal of Organic Chemistry. Band 27, Nr. 3, März 1962, S. 1064–1066, doi:10.1021/jo01050a523.
- ↑ S. Spyroudis, A. Varvoglis: Dehydrogenations with Phenyliodine Ditrifluoroacetate. In: Synthesis. Band 1975, Nr. 07, 1975, S. 445–447, doi:10.1055/s-1975-23796.
- ↑ Arthur F. Ferris, William D. Emmons: Metathetical Reactions of Silver Salts in Solution. I. The Synthesis of Acyl Trifluoroacetates 1. In: Journal of the American Chemical Society. Band 75, Nr. 1, Januar 1953, S. 232–233, doi:10.1021/ja01097a507.
- ↑ R. N. Haszeldine, A. G. Sharpe: 177. The reactions of metallic salts of acidss with halogens. Part II. The interaction of silver trifluoroacetate or silver perchlorate and halogens in various solvents. In: Journal of the Chemical Society (Resumed). 1952, S. 993, doi:10.1039/jr9520000993.
- ↑ M. J. Baillie, D. H. Brown, K. C. Moss, D. W. A. Sharp: Anhydrous metal trifluoroacetates. In: Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1968, S. 3110, doi:10.1039/j19680003110.
