Silberiodat
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Ag+ _ I5+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Silberiodat | ||||||||||||||||||
| Andere Namen |
Silber(I)-iodat | ||||||||||||||||||
| Verhältnisformel | AgIO3 | ||||||||||||||||||
| Kurzbeschreibung |
lichtempfindlicher weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 282,77 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
5,53 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−171,1 kJ/mol[3] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Silberiodat ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Iodate.
Gewinnung und Darstellung
Silberiodat kann durch Reaktion einer Silbernitrat-Lösung mit Kaliumiodat gewonnen werden.[4] Es kann auch durch Reaktion von Kaliumiodat mit einer Silbersulfat- oder Silberdithionatlösung gewonnen werden.
Eigenschaften
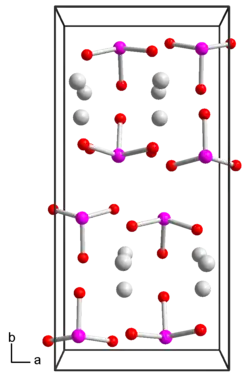
Silberiodat ist ein weißer lichtempfindlicher Feststoff, der praktisch unlöslich in Wasser aber löslich in Ammoniakwasser ist.[1] Bei Erhitzung zersetzt er sich zu Silberiodid und Sauerstoff. Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pbc21 (Raumgruppen-Nr. 29, Stellung 2).[2]
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Silver iodate, 99% bei Alfa Aesar, abgerufen am 10. November 2021 (Seite nicht mehr abrufbar).
- ↑ a b Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 286 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- ↑ GMELIN's Handbuch der anorganischen Chemie, 8. Auflage, Verlag Chemie GmbH, Teil B2, Silber-Verbindungen Seite 434

