Santal (Isoflavon)
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
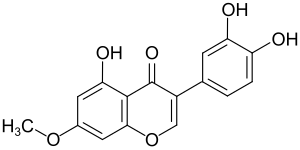
| Name | Santal (Isoflavon) | ||||||||||||
| Andere Namen |
7-Methoxy-3,4,5-trihydroxyisoflavon | ||||||||||||
| Summenformel | C16H12O6 | ||||||||||||
| Kurzbeschreibung |
gelblicher Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 300,26 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Dichte |
1,484 g·cm−3 (Monohydrat)[3] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Santal ist eine chemische Verbindung aus der Gruppe der Isoflavone, genauer ein Methoxyisoflavon.
Vorkommen

Santal kommt natürlich in Baphia nitida und Pterocarpus santalinus L., sowie Sandelholz, Rotholz und anderen Hölzern vor.[5][2]
Gewinnung und Darstellung
Santal kann durch Ringschluss von Desoxybenzoin mit Ethylformiat und Natrium gewonnen werden.[6]
Ebenfalls möglich ist die Darstellung durch Methylierung von 5:7:3′4′-Tetrahydroxy-Isoflavon mit Dimethylsulfat.[7]
Eigenschaften
Santal-Monohydrat ist ein gelber Feststoff, der eine orthorhombische Kristallstruktur mit der Raumgruppe Pca21 (Raumgruppen-Nr. 29) besitzt.[3]
Einzelnachweise
- ↑ Harry Raudnitz, Gertrud Perlmann: Über Santal, Pterocarpin und Homo-pterocarpin, die farblosen Begleiter des Santalins (II. Mitteil.). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 68, Nr. 9, 1935, S. 1862–1866, doi:10.1002/cber.19350680938.
- ↑ a b c Eckard Amelingmeier, Michael Berger, Uwe Bergsträßer, Henning Bockhorn, Peter Botschwina: RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999. Thieme, 2014, ISBN 978-3-13-199991-7, S. 2002 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b K. S. Knight, C. T. Smith, T. G. Waddell, B. Noll: Santal monohydrate, an isoflavone isolated from Wyethia mollis. In: Acta Crystallographica Section E: Structure Reports Online. Band 70, Nr. 3, 2014, S. o267–o267, doi:10.1107/S1600536814002670, PMID 24764982.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ A. Arnold: Aufbau · Speicherung · Mobilisierung und Umbildung der Kohlenhydrate. Springer Berlin Heidelberg, 2013, ISBN 978-3-642-94731-5, S. 601 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P.H. Abelson, H. Barkemeyer, K. Bernauer, A.E. Dimond, H.H. Inhoffen, K. Irmscher, F. Korte, I. Korte, H. Kuhn, W.A. Schroeder, B.B. Stowe, K. Venkataraman: Fortschritte Der Chemie Organischer Naturstoffe / Progress in the Chemistry... Springer Vienna, 2012, ISBN 978-3-7091-8052-5, S. 42 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ N. Narasimhachari, T. R. Seshadri: Synthetic experiments in the benzopyrone series. In: Proceedings of the Indian Academy of Sciences - Section A. Band 32, Nr. 5, 1950, S. 342, doi:10.1007/BF03170850.