Roseovarius
| Roseovarius | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Roseovarius | ||||||||||||
| Gosink et al 1998 |
Roseovarius ist eine Gattung von Bakterien. Die Mitglieder der Gattung Roseovarius sind physiologisch vielfältig, einige Arten zeigen die aerobe anoxygene Phototrophie, andere sind dazu in der Lage aromatische Kohlenwasserstoffe abzubauen. Einige Arten sind auch im Meer an dem Abbau von Dimethylsulfoniopropionat (DMSP) beteiligt.[1][2] Des Weiteren führen sie zur Energiegewinnung die Oxidation von Sulfit und Thiosulfat durch. Somit spielen sie eine wichtige Rolle im Schwefelkreislauf des Meeres. Sie zählen zu der Familie der Roseobacteraceae. Mitglieder dieser Familie machen bis zu 20 % der küstennahen marinen Bakterienpopulationen aus, was diese Familie zu einer der am häufigsten vorkommenden Gruppen von Bakterien in marinen Ökosystemen macht.[3]
Merkmale
Einigen Arten Roseovarius vermehren sich durch Knospung. Einige sind unbeweglich, andere Arten weisen eine taumelnde Motilität auf und auch Geißeln sind bei einigen Arten vorhanden. Die meisten eiförmigen oder stäbchenförmigen Bakterien benötigen typischerweise Natrium für das Wachstum. Der Katalase- und der Oxidase-Test fallen meist positiv aus. Viele Arten bilden die Polyhydroxybuttersäure als Reservestoff.[2]
Stoffwechsel und Wachstum
Die meisten Arten der Gattung Roseovarius sind aerob, sie sind auf Sauerstoff angewiesen. Eine Ausnahme ist z. B. Roseovarius conchicola, diese Art wurde als fakultativ anaerob identifiziert, sie kann also auch unter Sauerstoffausschluss wachsen. Die Arten sind in der Regel chemoorganotroph, d. h. sie benötigen organische Verbindung für den Stoffwechsel.[2]
Eine Ausnahme stellt z. B. die Art Roseovarius autotrophicus dar, sie kann chemolithoautotroph mit molekularem Wasserstoff als Elektronendonor und Nitrat als Elektronenakzeptor wachsen. Sie wurde aus einem Schlammvulkan isoliert.[4]
Viele Arten sind zur Photosynthese fähig, das Bacteriochlorophyll a wurde in mehreren Stämmen, wie z. B. von Stämmen der Arten R. tolerans und R. mucosus nachgewiesen (in letzterem allerdings nur schwach), und pufLM-Gene sind z. B. im Genom von R. indicus, R. tolerans und R. mucosus nachgewiesen. Die pufLM-Gene sind für die zwei Kernproteine des bakteriellen photosynthetischen Reaktionszentrums verantwortlich. Die Arten sind allerdings nicht photoautotroph, sie benötigen zusätzlich noch organische Stoffe für das Wachstum.[2]
Einige Arten, wie z. B. Roseovarius tolerans sind zur aeroben anoxygenen Photosynthese (AAP) fähig. Hierbei wird Wasser (im Gegensatz zu der pflanzlichen Photosynthese) nicht genutzt und Sauerstoff wird somit nicht produziert. Aerobe anoxygenische phototrophe Bakterien wachsen nicht photoautotroph und sind von der zusätzlichen Aufnahme von Kohlenstoff aus organischen Quellen abhängig. Man spricht von einem photoheterotrophen Stoffwechsel.[5][6] Bei Roseovarius-Arten und anderen Species der Familie Roseobacteraceae wird hierzu das Bakteriochlorophyll a eingesetzt.[2]
Ubichinon 10 ist das Hauptchinon der Atmung. Einige Arten benötigen Vitamine. Einige Roseovarius-Arten sind als Denitrifizierer beschrieben worden. Hierzu zählt wie z. B. R. crassostreae. In der Regel benötigen Roseovarius-Arten Natriumionen für ihr Wachstum, einige auch Magnesium (R. halocynthiae, R. marinus und R. sediminilitoris). Der Salzgehaltsbereich einiger Arten erreicht 20 % (R. halotolerans). Diese Arten sind als halophil („salzliebend“).[2]
Ökologie
Die Arten kommen meist im Meer vor, Funde stammen aus marinen Sedimenten, aus der Tiefsee, aus einem See in der Antarktis und auch aus dem freien Meerwasser.[2]
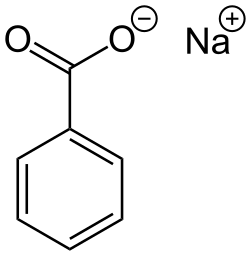
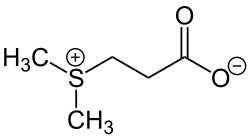
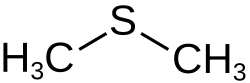
Ein herausragendes Merkmal von R. nubinhibens ist seine Fähigkeit, Dimethylsulfoniopropionat (DMSP) zu demethylieren, eine der wichtigsten Aktivitäten im marinen Schwefelzyklus. DMSP ist eine organische Schwefelverbindung, die in den Ozeanen vorkommt und eine wichtige Rolle im globalen Schwefelkreislauf spielt. DMSP wird hauptsächlich von Algen gebildet. Bakterien können aus DMSP das Dimethylsulfid (DMS) bilden, welches wichtig für die Wolkenbildung ist.[7]
Viele Arten von Roseovarius kommen innerhalb von Meerestieren vor und einige der Roseovarius-Arten sind auch krankheitserregend bei verschiedenen Tieren oder Algen. R. crassotreae ist Auslöser der juvenilen Austernkrankheit (JOD), auch „Roseovarius-Austernkrankheit“ (ROD) genannt, eine Krankheit, die die saisonale Sterblichkeit bei kommerziell produzierten Amerikanischen Austern (Crassostrea virginica) an der Nordostküste der USA verursacht. Stämme, die R. crassostreae ähneln, hängen auch mit dem “Australian Subtropical White Syndrome”, einer infektiösen, temperaturabhängigen Krankheit der Koralle Turbinaria mesenterina zusammen. Es scheint so, dass diese Stämme möglicherweise einfach als Opportunisten auftreten und nicht direkt die Krankheit verursachen.[2]
Mögliche Nutzung
Roseovarius tolerans DSM 11457 T und R. mucosus DSM 17069 T wurden dazu untersucht, Gold aus Elektronikschrott und sulfidischem Golderzkonzentrat mit Hilfe von Bioleaching zu gewinnen.[8] Roseovarius-Arten können wie N-Acylalaninmethylester (NAMEs) produzieren. NAMEs dienen zur Quorum sensing und dienen zur Kommunikation zwischen den einzelnen Bakterienzellen. Sie steuern z. B. die Biofilmbildung oder Produktion von Virulenzfaktoren, einige sind auch als Antibiotika einsetzbar.[9][10] Verschiedene Stämme von Roseovarius sind auch in der Lage, aromatische Verbindungen abzubauen und sind somit von Interesse für z. B. die Abwasserreinigung und Bioremediation.[11] So ist z. B. die Alge Ulva mutabilis mit der Hilfe von Roseovarius sp. und dem Bakterium Maribacter sp. dazu in der Lage, das Aromat Xenoestrogene abzubauen. Zu den Xenoestrogene gehören pharmakologische Östrogene, die z. B. Einsatz in Antibabypillen zu finden sind.[11] Roseovarius wird auch in Bezug auf die Herstellung von Vitamin B12 untersucht.[12][13]
Systematik
Roseovarius gehört zu der Abteilung der Pseudomonadota (früher bekannt als Proteobakterien) und hier zu den Alphaproteobakterien. Sie zählt zu der Familie Roseobacteraceae zur Ordnung der Rhodobacterales.
Es folgt eine Liste einiger Arten:[14]
- Roseovarius aestuarii Yoon et al. 2008
- Roseovarius algicolus Moon and Lee 2015
- Roseovarius amoyensis Li et al. 2019
- Roseovarius antarcticus Deng et al. 2015
- Roseovarius autotrophicus Slobodkina et al. 2023
- Roseovarius conchicola Ha et al. 2025
- Roseovarius crassostreae Boettcher et al. 2005
- Roseovarius faecimaris Cha et al. 2019
- Roseovarius gaetbuli Park et al. 2014
- Roseovarius halotolerans Oh et al. 2009
- Roseovarius marinus Jung et al. 2011
- Roseovarius mucosus Biebl et al. 2005
- Roseovarius nitratireducens Shen et al. 2018
- Roseovarius phycicola Lee et al. 2024
- Roseovarius ponticola Park et al. 2019
- Roseovarius spongiae Zhuang and Luo 2020
- Roseovarius tibetensis Lu et al. 2019
- Roseovarius tolerans Labrenz et al. 1999
Einzelnachweise
- ↑ Min Woo Lee, Ju Hye Baek, Jeong Min Kim, Hülya Bayburt, Byeong Jun Choi, Baolei Jia, Che Ok Jeon: Roseovarius phycicola sp. nov. and Roseovarius rhodophyticola sp. nov., isolated from marine red algae. In: International Journal of Systematic and Evolutionary Microbiology. Band 74, Nr. 11, 2024, ISSN 1466-5034, S. 006574, doi:10.1099/ijsem.0.006574, PMID 39527472, PMC 11554077 (freier Volltext) – (microbiologyresearch.org [abgerufen am 27. Mai 2025]).
- ↑ a b c d e f g h María J. Pujalte, Teresa Lucena, María A. Ruvira, David Ruiz Arahal, M. Carmen Macián: The Family Rhodobacteraceae. In: The Prokaryotes. Springer Berlin Heidelberg, Berlin, Heidelberg 2014, ISBN 978-3-642-30196-4, S. 439–512, doi:10.1007/978-3-642-30197-1_377 (springer.com [abgerufen am 7. April 2024]).
- ↑ Xiaokun Xu, Mengdan He, Qingjie Xue, Xiuzhen Li, Ang Liu: Genome-based taxonomic classification of the genus Sulfitobacter along with the proposal of a new genus Parasulfitobacter gen. nov. and exploring the gene clusters associated with sulfur oxidation. In: BMC Genomics. Band 25, Nr. 1, 22. April 2024, ISSN 1471-2164, doi:10.1186/s12864-024-10269-3, PMID 38649849, PMC 11034169 (freier Volltext) – (biomedcentral.com [abgerufen am 29. Mai 2025]).
- ↑ Galina Slobodkina, Nataliya Ratnikova, Alexander Merkel, Vadim Kevbrin, Alexandra Kuchierskaya, Alexander Slobodkin: Lithoautotrophic lifestyle of the widespread genus Roseovarius revealed by physiological and genomic characterization of Roseovarius autotrophicus sp. nov. In: FEMS Microbiology Ecology. Band 98, Nr. 10, 1. Oktober 2022, ISSN 0168-6496, doi:10.1093/femsec/fiac113 (oup.com [abgerufen am 27. Mai 2025]).
- ↑ Michael T. Madigan, John M. Martinko, Jack Parker: Brock – Mikrobiologie. 13. Auflage. Pearson Studium, München 2013, ISBN 978-3-86894-144-9.
- ↑ J. Overmann: Obligat aerobe anoxygen phototrophe Alphaproteobacteria. In: Fuchs G, Hrsg. Allgemeine Mikrobiologie. 11., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2021.
- ↑ Yin-Xin Zeng, Zong-Yun Qiao: Diversity of Dimethylsulfoniopropionate Degradation Genes Reveals the Significance of Marine Roseobacter Clade in Sulfur Metabolism in Coastal Areas of Antarctic Maxwell Bay. In: Current Microbiology. Band 76, Nr. 9, September 2019, ISSN 0343-8651, S. 967–974, doi:10.1007/s00284-019-01709-5 (springer.com [abgerufen am 28. Februar 2024]).
- ↑ Kanjana Kudpeng, Tsing Bohu, Christina Morris, Paitip Thiravetyan, Anna H. Kaksonen: Bioleaching of Gold from Sulfidic Gold Ore Concentrate and Electronic Waste by Roseovarius tolerans and Roseovarius mucosus. In: Microorganisms. Band 8, Nr. 11, 14. November 2020, ISSN 2076-2607, S. 1783, doi:10.3390/microorganisms8111783, PMID 33202548, PMC 7696734 (freier Volltext) – (mdpi.com [abgerufen am 27. Mai 2025]).
- ↑ Hilke Bruns, Jennifer Herrmann, Rolf Müller, Hui Wang, Irene Wagner Döbler, Stefan Schulz: Oxygenated N -Acyl Alanine Methyl Esters (NAMEs) from the Marine Bacterium Roseovarius tolerans EL-164. In: Journal of Natural Products. Band 81, Nr. 1, 26. Januar 2018, ISSN 0163-3864, S. 131–139, doi:10.1021/acs.jnatprod.7b00757 (acs.org [abgerufen am 28. Mai 2025]).
- ↑ Hilke Bruns, Verena Thiel, Sonja Voget, Diana Patzelt, Rolf Daniel, Irene Wagner‐Döbler, Stefan Schulz: N ‐Acylated Alanine Methyl Esters (NAMEs) from Roseovarius tolerans, Structural Analogs of Quorum‐Sensing Autoinducers, N ‐Acylhomoserine Lactones. In: Chemistry & Biodiversity. Band 10, Nr. 9, September 2013, ISSN 1612-1872, S. 1559–1573, doi:10.1002/cbdv.201300210 (wiley.com [abgerufen am 28. Mai 2025]).
- ↑ a b Justus B. Hardegen, Maximilian S. F. Knips, Johanna K. Däumer, Svenja Kretzer, Thomas Wichard: Biodegradation of Xenoestrogens by the Green Tide Forming Seaweed Ulva : A Model System for Bioremediation. In: ACS ES&T Water. Band 5, Nr. 3, 14. März 2025, ISSN 2690-0637, S. 1195–1206, doi:10.1021/acsestwater.4c00961, PMID 40110440, PMC 11915382 (freier Volltext) – (acs.org [abgerufen am 28. Mai 2025]).
- ↑ A joint bacterial effort to produce vitamin B12. In: Nature. 31. Juli 2024, ISSN 0028-0836, doi:10.1038/d41586-024-02474-7 (nature.com [abgerufen am 28. Mai 2025]).
- ↑ Gerrit Wienhausen, Cristina Moraru, Stefan Bruns, Den Quoc Tran, Sabiha Sultana, Heinz Wilkes, Leon Dlugosch, Farooq Azam, Meinhard Simon: Ligand cross-feeding resolves bacterial vitamin B12 auxotrophies. In: Nature. Band 629, Nr. 8013, 23. Mai 2024, ISSN 0028-0836, S. 886–892, doi:10.1038/s41586-024-07396-y (nature.com [abgerufen am 28. Mai 2025]).
- ↑ Roseovarius in LPSN.
Literatur
- María J. Pujalte, Teresa Lucena, María A. Ruvira, David Ruiz Arahal, M. Carmen Macián: The Family Rhodobacteraceae. In: The Prokaryotes. Springer Berlin Heidelberg, Berlin, Heidelberg 2014, ISBN 978-3-642-30196-4, S. 439–512, doi:10.1007/978-3-642-30197-1_377 (springer.com [abgerufen am 7. April 2024]).