Rheobase
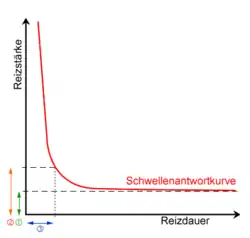
Die Rheobase (von altgriechisch ῥεῖν rhein, deutsch ‚fließen‘) ist definiert als der minimale Reiz, der erforderlich ist, um eine Nervenzelle zu erregen und ein Aktionspotential zu erzeugen. Die elektrische Stimulation eines peripheren Nervs führt je nach Morphologie des Nervs in der Regel zu Muskelzuckungen, Gefühllosigkeit oder einer Kombination aus beidem. Die Reizübertragung im Nervensystem ist ein komplexer Vorgang, bei dem elektrische und chemische Potentialänderungen (siehe Ruhepotential und Membranpotential) im Bruchteil einer Sekunde übertragen werden. Damit eine Stimulierung auf elektrischem Wege weitergeleitet werden kann, muss jedoch ein Schwellenwert für den Stromimpuls an den Nerv geliefert werden. Unterhalb dieser Schwelle wird kein Aktionspotential weitergeleitet. Das Verhältnis zwischen der Stärke und der Dauer des Stromflusses ist wichtig, um festzustellen, ob ein Nerv stimuliert wird. Dieses Verhältnis wird mit den Begriffen Rheobase und Chronaxie beschrieben.[1]
Bei der Betrachtung der Wirksamkeit eines intrazellulär applizierten Stromimpulses zur Auslösung eines Aktionspotentials ist nicht nur die Stromstärke zu berücksichtigen, sondern auch die Zeit, in der der Strom durch die Zelle bzw. den Nerven fließen kann. Durch die Wahl verschiedener Spannungen und Pulsdauern kann dann eine Reizstärke-Reizdauer-Kurve entwickelt werden, die diese beiden Faktoren mit dem effektiven Stimulationsniveau in Beziehung setzt und so einen Richtwert für die intrinsische Erregbarkeit des Neurons liefert.[2] Die Beziehung zwischen Reizstärke und Reizdauer ergibt sich aus der Tatsache, dass der gleiche minimale elektrische Strom, der zur Erregung eines Aktionspotentials erforderlich ist, durch einen kurzen, aber großen Strom oder durch einen langen, aber kleinen Strom erzeugt werden kann. Das Produkt aus Reizstärke und Reizdauer bestimmt die Erregbarkeit des Neurons, Nervs oder der Nervenfaser.[2] Mathematisch gesehen entspricht die Rheobase der Hälfte des Stroms, der für die Dauer der Chronaxie angelegt werden muss, einer Stärke-Dauer-Zeitkonstante, die der Zeitdauer entspricht, die eine Reaktion hervorruft, wenn der Nerv mit der doppelten rheobasischen Stärke stimuliert wird.[3]
Je nach Aktivität des Nervensystems (Vollnarkose oder unterschiedliche Wach-/Schlafzustände) können sich die Rheobase-Werte der Nerven ändern. Unter Narkose steigen die Rheobase-Werte an, aber die Chronaxie-Werte ändern sich nicht. Die Schwellenströme für die motorische Reaktion (Muskelaktivität) auf Nervenstimulation könnten unter Allgemeinanästhesie höher sein als bei wachen Patienten.[4] Die Rheobaseströme im „ruhigen Schlaf“ (nicht rasche Augenbewegungen; non-rapid eye movment NREM) sind mit denen im Wachzustand vergleichbar, während sie im „aktiven Schlaf“ (rasche Augenbewegung; rapid eye movement, REM) 80 % höher sind als im ruhigen Schlaf.[5]
Die Untersuchung der Erregbarkeit von Nerven ergänzt die herkömmlichen Untersuchungen der Nervenleitfähigkeit, indem sie Einblicke in die biophysikalischen Eigenschaften der Axone und die Funktion ihrer Ionenkanäle ermöglicht.[6] Die Rheobase wird durch die Erregbarkeit der nodalen Axonmembran (siehe: Ranvier-Schnürring) beeinflusst, die bei Hyperpolarisation zunimmt und bei Depolarisation abnimmt. Ihre Abhängigkeit vom Membranpotential folgt dem Verhalten persistenter Natriumkanäle, die nahe am Schwellenwert aktiv sind und schnell aktivierende und langsam inaktivierende Kanaleigenschaften haben.[7] Depolarisation erhöht den Strom durch die persistenten Natriumkanäle, was zu einer niedrigeren Rheobase führt; Hyperpolarisation hat den gegenteiligen Effekt. Die Kraft-Zeitkonstante steigt mit der Demyelinisierung, da die exponierte Membran durch die Einbeziehung der paranodalen (Bereich in myelinisierten Nervenfasern, in dem die Myelinendigungen spezielle Verbindungen mit der Axonmembran bilden) und internodalen Membran (Membran zwischen Ranvier-Schnürringen) vergrößert wird. Letztere hat die Aufgabe, das Ruhemembranpotential aufrechtzuerhalten, so dass eine internodale Dysfunktion die Erregbarkeit in einem erkrankten Nerv erheblich beeinflusst. Reizstärke-Reizdauer-Studien haben Einblicke in die Bedingungen gegeben, die zu Veränderungen des Ruhepotentials führen, wie z. B. Elektrolytkonzentration und pH-Wert, sowie in die spezifische Funktion von Ionenkanälen und Pumpen in normalen und erkrankten Nerven. Die Temperatur kann die Kinetik von Ionenkanälen beeinflussen und damit die Rheobase verändern. Das bedeutet, dass ein Strom, der bei einer bestimmten Temperatur ein Aktionspotential erzeugt, bei einer anderen Temperatur möglicherweise kein Aktionspotential erzeugt. Mit Hilfe von Software, die die Berechnung von Rheobasis und Zeitkonstanten von normalen und erkrankten Nerven ermöglicht, können einige wichtige Faktoren für eine Reihe von weit verbreiteten Nervenerkrankungen identifiziert werden, von denen viele mit einer starken Demyelinisierung einhergehen.[6][8]
Klinische Relevanz
Die Verwendung von Reizstärke-Reizdauer-Kurve wurde in den 1930er Jahren entwickelt, gefolgt von der Verwendung von Schwellenstrommessungen zur Untersuchung der axonalen Erregbarkeit des Menschen in den 1970er Jahren.[1] Die Anwendung dieser Methoden bei toxischen Neuropathien hat es Forschern ermöglicht, protektive Faktoren für viele Krankheiten des periphere Nervensystems und mehrere Erkrankungen des zentralen Nervensystems zu identifizieren.[7][8]
Einzelnachweise
- ↑ a b Werner Irnich: The terms "chronaxie" and "rheobase" are 100 years old. In: Pacing Clin Electrophysiol. Band 33, Nr. 4, 2010, S. 491, doi:10.1111/j.1540-8159.2009.02666.x, PMID 20132498.
- ↑ a b Walter F Boron, Emile L Boulpaep: Medical Physiology. Chapter 7, Section II. 3. Auflage. Elsevier, ISBN 978-0-323-65530-9.
- ↑ David Boinagrov, Jim Loudin, Daniel Palanker: Strength-duration relationship for extracellular neural stimulation: numerical and analytical models. In: J Neurophysiol. Band 104, Nr. 4, 2010, S. 2236, doi:10.1152/jn.00343.2010, PMID 20702740.
- ↑ B C Tsui: The effects of general anaesthesia on nerve-motor response characteristics (rheobase and chronaxie) to peripheral nerve stimulation. In: Anaesthesia. Band 69, Nr. 4, 2014, S. 374, doi:10.1111/anae.12540, PMID 24641644.
- ↑ Michael H. Chase, Francisco R. Morales: Chapter 12 - Control of Motoneurons during Sleep. In: Meir H. Kryger, Thomas Roth, William C. Dement (Hrsg.): Principles and Practice of Sleep Medicine (Fourth Edition). 4. Auflage. Elsevier, 2005, ISBN 978-0-7216-0797-9, S. 154–168, doi:10.1016/B0-72-160797-7/50019-7.
- ↑ a b Christian Krarup, Mihai Moldovan: Nerve conduction and excitability studies in peripheral nerve disorders. In: Curr Opin Neurol. Band 22, Nr. 5, 2009, S. 460, doi:10.1097/WCO.0b013e3283304c9d, PMID 19625961.
- ↑ a b Hiroyuki Nodera, Ryuji Kaji: Nerve excitability testing and its clinical application to neuromuscular diseases. In: Clin Neurophysiol. Band 117, Nr. 9, S. 1902, doi:10.1016/j.clinph.2006.01.018, PMID 16631406.
- ↑ a b I Mogyoros, MC Kiernan, D Burke, H Bostock: Excitability changes in human sensory and motor axons during hyperventilation and ischaemia. In: Brain. Band 120, Nr. 2, 1997, S. 317, doi:10.1093/brain/120.2.317, PMID 9117378.