Platin(IV)-fluorid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Platin(IV)-fluorid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | PtF4 | ||||||||||||
| Kurzbeschreibung |
dunkelroter Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 271,08 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
6,12 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Platin(IV)-fluorid ist eine chemische Verbindung des Platins aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Platin(IV)-fluorid kann durch Reaktion von Brom(III)-fluorid mit Platin(II)-chlorid bei etwa 200 °C oder durch Elektrolyse von Fluorwasserstoff mit Platin gewonnen werden.[4][5][6] Bei der Darstellung durch Brom(III)-fluorid ist die hergestellte Verbindung in der Regel mit Brom verunreinigt, das durch Fluorierung bei niedriger Temperatur entfernt werden kann. Ein anderer Ansatz zur Darstellung von Platin(IV)-fluorid ist die wiederholte thermische Zersetzung von Mischungen aus Platinhexafluorid und niedrigeren Platinfluoriden, die schließlich ebenfalls zu Platin(IV)-fluorid führt. Einfacher lässt sich die Verbindung aus Platin und Xenondifluorid synthetisieren.[7] Weitere Synthesen sind ebenfalls bekannt.[8]
Eigenschaften
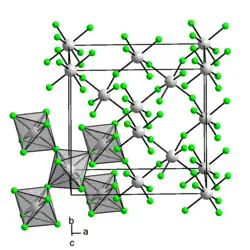
Platin(IV)-fluorid liegt in Form einer dunkelroten Masse oder kleiner braungelber Kristalle vor. Die Verbindung ist sehr hygroskopisch und zersetzt sich in Wasser.[1] Oberhalb des Schmelzpunktes zersetzt sich die Verbindung zu Platin und Fluor.[6] Sie besitzt eine monokline Kristallstruktur mit der Raumgruppe Fdd2 (Raumgruppen-Nr. 43).[9][10]
Einzelnachweise
- ↑ a b c d Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer Berlin Heidelberg, 2013, ISBN 978-3-642-58842-6, S. 676 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, ISBN 978-1-4822-6097-7, S. 81 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Arnold F. Holleman: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. De Gruyter, 2016, ISBN 978-3-11-049339-9.
- ↑ Stanley E. Livingstone: The Chemistry of Ruthenium, Rhodium, Palladium, Osmium, Iridium and Platinum. Elsevier Science, 2017, ISBN 978-1-4831-5840-2, S. 1359 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Iosif Grigorʹevich Ryss: The Chemistry of Fluorine and Its Inorganic Compounds. State Publishing House for Scientific, Technical and Chemical Literature, 1960, S. 689 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Axel Haupt: Organic and Inorganic Fluorine Chemistry. De Gruyter, 2021, ISBN 978-3-11-065933-7, S. 249 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. A Bondarenko, M. V Korobov, V. N Mitkin, L. N Sidorov: Enthalpy of sublimation of platinum tetrafluoride. In: The Journal of Chemical Thermodynamics. Band 20, Nr. 3, 1988, S. 299–303, doi:10.1016/0021-9614(88)90125-5.
- ↑ A. V. Dzhalavyan, Eduard G. Rakov, A. S. Dudin: Platinum Metal Fluorides. In: Russian Chemical Reviews. Band 52, Nr. 10, 1983, S. 960–972, doi:10.1070/RC1983v052n10ABEH002908.
- ↑ B. G. Mueller, M. Serafin: ChemInform Abstract: Single-Crystal Investigations on PtF4 and PtF5. In: ChemInform. Band 29, Nr. 45, 1992, S. 625–633, doi:10.1002/chin.199245006.