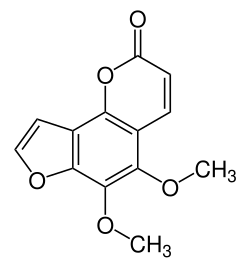
Pimpinellin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pimpinellin | ||||||||||||||||||
| Summenformel | C13H10O5 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 246,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
119 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Pimpinellin ist eine natürlich vorkommende organische Verbindung aus der Gruppe der Furocumarine. Formal handelt es sich um ein Derivat des Angelicins mit zwei zusätzlichen Methoxygruppen am mittleren Ring.
Vorkommen

Pimpinellin kommt in der kleinen Bibernelle,[2] im Wiesen-Bärenklau (Heracleum sphondylium)[3] und Heracleum laciniatum[4] vor.
Synthese
Eine mögliche Totalsynthese des Pimpinellins geht vom Vanillin aus. Dieses wird durch Reaktion mit Brom in Essigsäure meta zum Aldehyd bromiert und das Bromatom dann durch Reaktion mit Kupfer und Natronlauge in eine Hydroxygruppe überführt. Durch Reaktion mit Dimethylsulfat kann dann die andere Hydroxygruppe (para zum Aldehyd) selektiv methyliert werden. Durch Reaktion mit N-Bromsuccinimid kann anschließend ortho zum Aldehyd wiederum ein Bromatom eingeführt werden. Durch Sonogashira-Kupplung mit Triisopropylsilylacetylen, Kupfer(I)-iodid, Triethylamin und (Bis(diphenylphosphino)ferrocen)palladium(II)-chlorid kann dann am Aromaten eine Alkin-Einheit eingeführt werden. Durch Reaktion mit Tetrabutylammoniumfluorid wird die Triisopropylsilylgruppe abgespalten und unter Cyclisierung ein Benzofuran gebildet. Durch Baeyer-Villiger-Oxidation mit meta-Chlorperbenzoesäure wird die Aldehydgruppe in ein Formiat überführt und dann mit Ammoniak in Methanol zum Phenol verseift. Durch Reaktion mit Trimethylsilylpropiolsäure in Gegenwart von 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid kann wiederum eine Alkineinheit eingeführt und mit Echavarrens Katalysator, einer Gold(I)-verbindung der Lactonring aufgebaut werden.[5]
Eine alternative Synthese geht von Quadratsäuredimethylester aus. Dieser wird mit Lithiumtrimethylsilylacetylid alkinyliert, dann mit 2-Furyllithium umgesetzt um eine Furan-Einheit an eine der Carbonylgruppen zu addieren. Durch Erhitzen in Toluol wird ein Benzofuran gebildet, das zwei Hydroxygruppen trägt, die mit Methyliodid in Gegenwart von Kaliumcarbonat und [18]Krone-6 methyliert werden können. Durch Reaktion mit Silbernitrat und Kaliumcyanid kann die Trimethylsilylgruppe entschützt werden. Durch Oxidation mit Ammoniumcer(IV)-nitrat können die Methoxygruppen demethyliert und ein Chinon gebildet werden. Anschließend kann durch Deprotonierung mit Butyllithium und Reaktion mit Methylchlorformiat eine Methoxycarbonylgruppe eingeführt werden. Durch Lindlar-Hydrierung werden gleichzeitig die Chinoneinheit und die Dreifachbindung reduziert, was direkt zur Bildung des Lacton-Rings führt.[6]
Einzelnachweise
- ↑ a b c d Datenblatt Pimpinellin bei Sigma-Aldrich, abgerufen am 16. Juni 2025 (PDF).
- ↑ Fritz Wessely, Ferdinand Kallab: Über die Inhaltsstoffe der Wurzel von Pimpinella saxifraga I. In: Monatshefte für Chemie. Band 59, Nr. 1-2, März 1932, S. 162–175, doi:10.1007/BF01638226.
- ↑ Gudrun Abel, Clemens Erdelmeier, Beat Meier, Otto Sticher: Iso-Pimpinellin, ein Furanocumarin aus Heracleum sphondylium mit chromosomenschädigender Aktivität. In: Planta Medica. Band 51, Nr. 03, Juni 1985, S. 250–252, doi:10.1055/s-2007-969470.
- ↑ G. Kavli, K. Midelfart, J. Raa, G. Volden: Phototoxicity from furocoumarins (psoralens) of Heracleum laciniatum in a patient with vitiligo. Action spectrum studies on bergapten, pimpinellin, angelicin and sphondin. In: Contact Dermatitis. Band 9, Nr. 5, Oktober 1983, S. 364–366, doi:10.1111/j.1600-0536.1983.tb04429.x.
- ↑ Aymeric Cervi, Paul Aillard, Nourallah Hazeri, Laurent Petit, Christina L. L. Chai, Anthony C. Willis, Martin G. Banwell: Total Syntheses of the Coumarin-Containing Natural Products Pimpinellin and Fraxetin Using Au(I)-Catalyzed Intramolecular Hydroarylation (IMHA) Chemistry. In: The Journal of Organic Chemistry. Band 78, Nr. 19, 4. Oktober 2013, S. 9876–9882, doi:10.1021/jo401583q.
- ↑ Michael W. Reed, Harold W. Moore: Efficient synthesis of furochromone and furocoumarin natural products (khellin, pimpinellin, isophellopterin) by thermal rearrangement of 4-furyl-4-hydroxycyclobutenones. In: The Journal of Organic Chemistry. Band 53, Nr. 18, September 1988, S. 4166–4171, doi:10.1021/jo00253a002.
