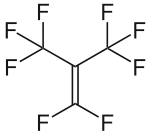
Perfluorisobuten
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Perfluorisobuten | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4F8 | |||||||||||||||
| Kurzbeschreibung |
farbloses, nicht brennbares Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 200,03 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Perfluorisobuten (PFIB) ist ein farbloses gasförmiges perfluoriertes Alken von extremer Toxizität.
Geschichte
In der Sowjetunion wurde die Verwendung von PFIB als Kampfstoff untersucht. Die einfache Herstellung durch Erhitzen von Polytetrafluorethylen (PTFE) und die Eigenschaft, dass Schutzmasken mit Aktivkohlefilter gegen PFIB nutzlos sind, machten das Gas interessant.[3] Heute ist PFIB unter der Chemiewaffenkonvention (Liste 2) verboten.[4]
Herstellung
Perfluorisobuten kann durch Pyrolyse von Perfluorcyclobutan bei 720 °C hergestellt werden.[5] Eine andere, ähnliche Herstellungsmethode ist die Pyrolyse von Perfluorpropen bei 750 °C.[6] Auch ist die Herstellung aus Polytetrafluorethylen möglich, dabei wird dieses zunächst bei 450 °C depolymerisiert und die Monomere dann auf 700 °C erhitzt, wobei ein Gemisch an Dimeren entsteht. Dabei ist das Perfluorisobuten das bevorzugte und bei Weitem überwiegende Produkt.[7]
Eigenschaften und Reaktionen
Die Oxidation von Perfluorisobuten durch Einleiten in eine Lösung von Kaliumpermanganat ergibt Hexafluoraceton-Hydrat. Dieses kann mit Phosphorpentoxid zum Hexafluoraceton dehydratisiert werden.[7] Perfluorisobuten reagiert unter sauren oder neutralen Bedingungen leicht mit Nukleophilen, wobei meist die Substitution eines Fluoratoms an der Doppelbindung auftritt. Je nach der konkreten Natur des Nukleophils kommt es zu einer doppelten Substitution oder - wegen sterischer Hinderung - nur zu einer einfachen Substitution. Eine Substitution in allylischer Position ist ebenfalls möglich, spielt jedoch eine untergeordnete Rolle.[8]
Toxizität
PFIB ist etwa zehnmal toxischer als Phosgen.[2] Die Inhalation kann zu einem Lungenödem führen, wobei Symptome teilweise erst nach einer Latenzzeit von mehreren Stunden auftreten. Der Wirkmechanismus ist analog zu dem von Phosgen, das heißt es kommt zu einer Reaktion mit einer doppelten Substitution mit Thiolgruppen am PFIB, die C(CF3)2-Gruppe verhält sich analog zum Carbonylsauerstoff im Phosgen.[8] PFIB kann bei der Pyrolyse von PTFE entstehen und das Polymerfieber auslösen.[3]
Einzelnachweise
- ↑ a b c d Eintrag zu Perfluorisobutylen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ a b c Jiri Patocka: Perfluoroisobutene: Poisonous Choking Gas. In: Military Medical Science Letters. Band 88, Nr. 3, 6. September 2019, S. 98–105, doi:10.31482/mmsl.2019.006 (mmsl.cz [PDF]).
- ↑ a b Charles Edward Stewart: Weapons of Mass Casualties and Terrorism Response Handbook. Jones & Bartlett Learning, 2006, ISBN 978-0-763-72425-2, S. 42 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Schedule 2. Abgerufen am 5. Juni 2025 (englisch).
- ↑ T. J. Brice, J. D. LaZerte, L. J. Hals, W. H. Pearlson: The Preparation and Some Properties of the C 4 F 8 Olefins 1. In: Journal of the American Chemical Society. Band 75, Nr. 11, Juni 1953, S. 2698–2702, doi:10.1021/ja01107a044.
- ↑ John Adams Young, Thomas McKennan Reed: The synthesis of perfluoroisobutylene from perfluoropropylene. In: The Journal of Organic Chemistry. Band 32, Nr. 5, Mai 1967, S. 1682–1683, doi:10.1021/jo01280a116.
- ↑ a b A. T. Morse, P. B. Ayscough, L. C. Leitch: ORGANIC FLUORINE COMPOUNDS: I. AN IMPROVED SYNTHESIS OF HEXAFLUOROACETONE. In: Canadian Journal of Chemistry. Band 33, Nr. 3, 1. März 1955, S. 453–457, doi:10.1139/v55-055.
- ↑ a b Christopher M Timperley: Fluoroalkene chemistry. In: Journal of Fluorine Chemistry. Band 125, Nr. 5, Mai 2004, S. 685–693, doi:10.1016/j.jfluchem.2003.11.021.

