Oxepin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
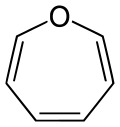
| ||||||||||
| Allgemeines | ||||||||||
| Name | Oxepin | |||||||||
| Summenformel | C6H6O | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 94,11 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Siedepunkt | ||||||||||
| Brechungsindex |
1,5162[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Oxepin ist der einfachste ungesättigte sauerstoffhaltige siebengliedrige Heterocyclus.
Darstellung
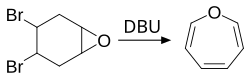
Oxepin kann durch die chemische Reaktion von 4,5-Dibromo-Cyclohexenoxid mit einer Base gewonnen werden. Hierbei handelt es sich um eine Eliminierungsreaktion. Gillard et al. verwendeten hierzu DBU als Base.[3]
Eigenschaften
Oxepin besitzt kein aromatisches System, es steht im Gleichgewicht mit Benzoloxid:[4]
In diesem Valenztautomerie-Gleichgewicht haben beide Komponenten annähernd gleichen Anteil.[5]
Einzelnachweise
- ↑ a b E. Vogel, A. Schubart, W. A. Böll in: Synthese eines Oxepins, Angew. Chem. 1964, 76, 535.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J. R. Gillard, M. J. Newlands, J. N. Bridson, D. J. Burnell: π-Facial stereoselectivity in the Diels–Alder reactions of benzene oxides. In: Canadian Journal of Chemistry. 69 (9), 1991, S. 1337–1343, doi:10.1139/v91-199.
- ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 352, ISBN 3-211-81060-9.
- ↑ E. Vogel, H. Günther: Benzoloxid-Oxepin-Valenztautomerie In: Angewandte Chemie. Band 79, 1967, S. 429–446