Nitrosopumilus
| Nitrosopumilus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Nitrosopumilus maritimus mit teils anhaftenden Virionen von Nitrosopumilus spindle-shaped virus 1 (Thaspiviridae). | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Nitrosopumilus | ||||||||||||
| Qin et al. 2017 |
Nitrosopumilus ist eine im Meerwasser sehr häufig vorkommende Gattung von Archaeen aus dem Reich Thermoproteati (früher „TACK-Superphylum“). Die Gattung ist das erste Mitglied der Ordnung Nitrosopumilales (früher: Gruppe 1a) der Klasse Nitrososphaeria („Thaumarchaeen“) von der ein Vertreter in Reinkultur isoliert werden konnte und wurde früher auch als Marine Group I (MG-I) bezeichnet.[1][2][3]
Gensequenzen deuten darauf hin, dass die Nitrosopumilales im oligotrophen Bereichen der Ozeanoberflächen allgegenwärtig sind und in den meisten nicht zu küstennahen Meereszonen der Erde vorkommen.[4] Die Typusart der Gattung ist Nitrosopumilus maritimus (mit Referenzstamm SCM1), ein Organismus, der von der Oxidation von Ammoniak (bzw. Ammonium-Ionen) zu Nitrit lebt. Der für die Oxidation von Ammoniak benötigte Sauerstoff kann dabei ggf. über einen besonderen Stoffwechselweg produziert werden, der neben Sauerstoff (O2) auch Distickstoff (N2) erzeugt. N. maritimus ist damit von der Anwesenheit von Sauerstoff unabhängig und gehört zu den Organismen, die im Dunkeln Sauerstoff produzieren können.[5][6][7]
Beschreibung
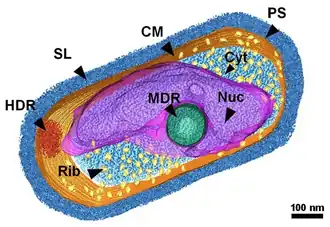

Die Typusart, Nitrosopumilus maritimus ist ein Ammoniak-oxidierender Vertreter der „Thaumarchaeota“ (heute offiziell Nitrososphaeria) und wurde 2005 aus einem Aquarium isoliert. Es war das erste Mitglied dieser Archaeengruppe, das erfolgreich kultiviert werden konnte.[7]
Früher dachte man, dass Archaeen nur in extremen Umgebungen vorkommen. Aber bereits 1992 wurde eine 16S-rRNA-Sequenz in „gewöhnlicher“ Meeresumwelt entdeckt, von der man annahm, dass sie zu den Archaeen gehört, und die als marine Archaeengruppe 1 (MAG-1) oder ähnlich bezeichnet wurde. Mitglieder dieser Gruppe waren jedoch schwer zu isolieren; obwohl mit „Candidatus Cenarchaeum symbiosum“ 1996 ein symbiotisch in Schwämmen lebender Vertreter entdeckt wurde, wurden kaum Fortschritte erzielt, und die Ökologie dieser Organismen blieb ein Rätsel.[7]
Im Jahr 2005 wurde dann Nitrosopumilus maritimus aus einem Aquarium für tropische Meeresfische im Seattle Aquarium isoliert (Stamm SCM1). Aufgrund der Morphologie und der 16S-rRNA-Sequenz wurde gleich vermutet, dass dieser Organismus zu den oben erwähnten marinen Archaeengruppe 1 (MAG-1) gehört. Wie man herausfand, kann dieses Archaeon autotroph wachsen, indem es Ammoniak zu Nitrit oxidiert. Außerdem kann die DNA eng verwandter Archaeen kann im Boden nachgewiesen werden. Die nachgewiesene Menge Ammoniak-oxidierender Archaeen (AOA) könnte 10-100 mal höher sein als die von ammoniakoxidierenden Bakterien (AOB). Man nimmt daher an, dass die AOA eine wichtige Position im Stickstoffkreislauf einnehmen.[7] Ähnliche Nitrit-Archaeen, jedoch thermophile, wurden 2007 mit „Ca. Nitrososphaera gargensis“ und 2008 mit „Ca. Nitrosocaldus yellowstonensis“ gefunden.[9]
Die Gestalt (Morphologie) der Zellen von N. maritimus ist stäbchenförmig mit einer Größe von etwa 0,5 µm und einem Durchmesser von 0,2 µm. Das Genom dieses Archaeons wurde im Jahr 2007 entschlüsselt, seine Größe beträgt 1.645.259 Basenpaare (1.795 ORFs); die offizielle Erstbeschreibung erfolgte 2017.[7]
Systematik
Arten
Die gegenwärtig (Juli 2025) akzeptierte Taxonomie der Gattung basiert auf folgenden Quellen:
- L – List of Prokaryotic names with Standing in Nomenclature (LPSN)[9]
- N – National Center for Biotechnology Information (NCBI)[10]
- G – Genome Taxonomy Database (GTDB)[11]
- W – World Register of Marine Species (WoRMS)[12]
- Z – Dayu Zou et al. (2020)[13]
Gattung Nitrosopumilus Qin et al. 2017(L,N,G),[7] [„Candidatus Nitrosopumilus“ Könneke et al. 2005(L,N) bzw. Könneke, Bernhard, de la Torre, Walker, Waterbury & Stahl, 2005(W)[6]], mit möglichem Synonym „Ca. Nitrosomarinus“ Ahlgren et al. 2017[14][15]
- Spezies Nitrosopumilus adriaticus Bayer et al. 2019(L,N,G)[8] [inkl. N. sp. NF5(N), Nitrosopumilus sp. CCS1(N)[A. 1]]
- Spezies „Ca. Nitrosopumilus aestuariumsis“ Zou et al. 2020(L,N,Z)[A. 2]
- Stämme S1bin1; S2bin1; S3bin1; W1bin1; W2bin3(N,Z)
– Fundort: Probeorte S1, S2, S3 (Sedimentproben); W1 und W2 (Wasserproben) im Ästuar des Jiulong Jiang, Fujian, China(Z)
- Stämme S1bin1; S2bin1; S3bin1; W1bin1; W2bin3(N,Z)
- Spezies „Ca. Nitrosopumilus brisbanensis“ Prabhu et al. 2024(N,G) [ Nitrosopumilus sp. isolate 32_1(N)]
- Referenzstamm 139563_S164_maxbin_bins.tsv.144(N,G)
– Fundort: Ästuar des Brisbane River, Queensland, Australien(N) - Stamm 139550_S152_metabat_bins_sspec.tsv.002(N,G)
– Fundort: Ästuar des Brisbane River, Queensland, Australien(N) - Stamm 32_1(N,G)
– Fundort: Küstengewässer um Salepo Island,[18] Georgia, USA(N)
- Referenzstamm 139563_S164_maxbin_bins.tsv.144(N,G)
- Spezies „C. Nitrosopumilus catalinensis“ (Ahlgren et al. 2017) Rinke et al. 2020(L,G) [„Ca. Nitrosomarinus catalinensis“ corrig. Ahlgren et al. 2017(L), „Ca. Nitrosomarinus catalina“ Ahlgren et al. 2017(L)[14][15]]
- Referenzstamm SPOT01(L,G)
– Fundort: Küstengewässer Kaliforniens, Pazifik(N) - Stamm SFB_27S_18Oct17_05_1(G)
– Fundort: Bucht von San Francisco (SFB), Kalifornien(N) - Stamm SFB27(G)
– Fundort: Bucht von San Francisco (SFB), Kalifornien(N)
- Referenzstamm SPOT01(L,G)
- Spezies „Nitrosopumilus cobalaminigenes“ Qin et al. 2017(L,N,G) [inkl. Nitrosopumilus sp. HCA1(N)[19], Ca. Nitrosopumilus sp. HCA1(N)]
- Referenzstamm HCA1(L,N,G) alias ATCC TSD-96(L,N)
– Fundort: Puget Sound, Salish Sea, Pazifik
- Referenzstamm HCA1(L,N,G) alias ATCC TSD-96(L,N)
- Spezies „Ca. Nitrosopumilus cymbastelae“ corrig. Zhang et al. 2019(L) [„Ca. Nitrosopumilus cymbastelus“ Zhang et al. 2019(L)[16]]
- – Wirt: Schwamm Cymbastela concentrica
- Spezies „Ca. Nitrosopumilus detritiferus“ Zhang et al. 2019(L) [Nitrosopumilus sp003724285(G), Nitrosopumilus sp. H13(N), Nitrosopumilus sp. H8(N)]
- Spezies „Ca. Nitrosopumilus hexadellae“ corrig. Zhang et al. 2019(L) [Ca. Nitrosopumilus hexadellus Zhang et al. 2019(L)[16], Nitrosopumilus sp003724325(G), inkl. Nitrosopumilus sp. D6(N), Nitrosopumilus sp. B06(N)]
- Spezies „Ca.Nitrosopumilus koreensis“ Park et al. 2012[20] bzw. Kim et al. 2011(L,N,G) [Nitrosopumilus sp. SJ(N)[A. 1]]
- Referenzstamm AR1(L,N,G,Z)[21][16]
– Fundort: marines Sediment vor Spitzbergen[20] - Stamm SJ(N,G)
- Referenzstamm AR1(L,N,G,Z)[21][16]
- Spezies „Ca. Nitrosopumilus limneticus“ Klotz et al. 2022(L,N,G)[22] Nitrosopumilus sp. isolate Baikal-deep-G182(N), Nitrosopumilus sp. Baikal-deep-G182[22]]
- Spezies Nitrosopumilus maritimus Qin et al. 2017(L,N) [„Ca. Nitrosopumilus maritimus“ Könneke et al. 2005(L,N,G)[7] bzw. Könneke, Bernhard, de la Torre, Walker, Waterbury & Stahl, 2005(W)[6]] – Typusart(L,G)
- Spezies „Nitrosopumilus oxyclinae“ Qin et al. 2017(L,N,G)[7] [inkl. Nitrosopumilus sp. HCE1(N)]
- Referenzstamm HCE1(L,N,G) alias ATCC TSD-98(L,N)
– Fundort: Salzwasser in einer Tiefe von 17 m (untere euphotische Zone), Hood Canal, Puget Sound, US-Bundesstaat Washington[7]
- Referenzstamm HCE1(L,N,G) alias ATCC TSD-98(L,N)
- Spezies Nitrosopumilus piranensis Bayer et al. 2019(L,N,G)[8] [inkl. Nitrosopumilus sp. D3C(N), Nitrosopumilus sp. b2(N)]
- Spezies „Ca. Nitrosopumilus salarius“ corrig. Mosier et al. 2012(L,N) [„Ca. Nitrosopumilus salaria“ Mosier et al. 2012(L,N,G)]
- Referenzstamm BD31(L,N,G,Z)
– Fundort: Bucht von San Francisco (SFB), Kalifornien(N)
- Referenzstamm BD31(L,N,G,Z)
- Spezies „Ca. Nitrosopumilus sediminis“ Park et al. 2012(L,N,G) [inkl. Ca. Nitrosopumilus sp. AR2(N)]
- Referenzstamm AR2(L,N,G,Z)[16]
– Fundort: Spitzbergen
- Referenzstamm AR2(L,N,G,Z)[16]
- Spezies „Nitrosopumilus ureiphilus“ Qin et al. 2017(L,N,G)[7] [inkl. Nitrosopumilus sp. PS0(N), Ca. Nitrosopumilus sp. PS0(N)]
- Referenzstamm PS0(L,N,G) alias ATCC TSD-99(L,N)
– Fundort: Küstennahes Sediment bei Seattle , USA(N)
- Referenzstamm PS0(L,N,G) alias ATCC TSD-99(L,N)
- Spezies Nitrosopumilus zosterae Nakagawa et al. 2021(L,N,G),[25] [inkl. Nitrosopumilus sp. NM25(N)]
- Referenzstamm NM25(L,N,G) alias ATCC TSD-147; NBRC 111181(L,N)
– Fundort: aus dem Sand einer Seegraszone vor der Küste von Shimoda (Izu-Halbinsel, Präfektur Shizuoka, Japan) isoliert.[25] - Stamm ECS34A1(N,G)
– Fundort: Shengshan[26]-Ozean, Ostchinesisches Meer - Stamm NBM25(G)
- Referenzstamm NM25(L,N,G) alias ATCC TSD-147; NBRC 111181(L,N)
- Nitrosopumilus sp000746765(G) [Thaumarchaeota RSA(Z), Marine Group I thaumarchaeote SCGC RSA3(N)]
- Referenzstamm SCGC AAA799-D11(N,G)
– Fundort: Sole-See-Wasser-Grenzfläche (brine-seawater interface), Atlantis II Tiefsee-Becken, Rotes Meer(N) - Stamm SGC RSA3(N,G) alias RSA3(Z)
– Fundort: Sole-See-Wasser-Grenzfläche (brine-seawater interface), Atlantis II Tiefsee-Becken, Rotes Meer(N) - Stämme SCGC AAA799-P11; SCGC AAA799-B03; SCGC AAA799-E16; SCGC AAA799-E16; SCGC AAA799-N04(G)
- Referenzstamm SCGC AAA799-D11(N,G)
- Spezies Nitrosopumilus sp001437625(G) [Nitrosopumilus sp. BACL13 MAG-121220-bin23(N)]
- Referenzstamm BACL13 MAG-121220-bin23(N,G)
– Fundort: brackiges Oberflächenwasser vor Öland, Ostsee(N,G) - Stämme UBA9319; RIS_SAG_22; UBA9278; ERR2206759_bin.70_CONCOCT_v1.1_MAG; P24860_108_MAG_170(G)
- Referenzstamm BACL13 MAG-121220-bin23(N,G)
- Spezies Nitrosopumilus sp001510275(G) [Thaumarchaeota archaeon casp-thauma3(N)]
- Referenzstamm casp-thauma3(N,G)
– Fundort: Kaspisches Meer bei Bābolsar(N)
- Referenzstamm casp-thauma3(N,G)
- Spezies Nitrosopumilus sp001541925(G) [Nitrosopumilus sp. Nsub(N)]
- Referenzstamm Nsub(N,G)
– Wirt: Schwämme der Gattung Suberites an kaltem Sickerwasser - Stämme CAS150M-72; casp150-mb.102(N,G)– Fundort: Kaspisches Meer bei Bābolsar in 150 m Tiefe(N)
- Referenzstamm Nsub(N,G)
- Spezies Nitrosopumilus sp001543015(G) [Nitrosopumilus sp. LS_AOA(N)]
- Spezies Nitrosopumilus sp002317795(G) [Nitrososphaerota archaeon isolate NORP47(N)]
- Referenzstamm NORP47(N,G)
– Fundort: North Pond, Atlantik(N) - Stamm CB6_Bottom.20(N,G)
– Fundort: in 10 m Höhe über dem Boden der Wassersäule im Canada Basin,[29] Arktischer Ozean(N)
- Referenzstamm NORP47(N,G)
- Spezies Nitrosopumilus sp002506665(G) [Nitrosopumilus sp. UBA526(N), Nitrosopumilus sp. UBA527(N)]
- Referenzstamm UBA526(N,G)
– Eirt. Tiefsee-Schwamm Neamphius huxleyi - Stamm UBA527(N,G)
- Referenzstamm UBA526(N,G)
- Spezies Nitrosopumilus sp002690535(G) [Nitrosopumilus sp. isolate MED-G94(N)]
- Referenzstamm MED-G94(N,G)
– Fundort: vor der Küste von Alivante, Spanien(N) - Stämme MOX_bin43; …(G)
- Referenzstamm MED-G94(N,G)
- Spezies Nitrosopumilus sp002730325(G) [Nitrososphaerota archaeon isolate NP142(N)]
- Referenzstamm NP142(N,G)
– Fundort: Nordatlantik(N) - Stämme ETNP14_MAG_6; …(G)
- Referenzstamm NP142(N,G)
- Spezies Nitrosopumilus sp002788515(G) [Nitrosopumilales archaeon CG_4_9_14_0_2_um_filter_34_16(N)]
- Referenzstamm CG_4_9_14_0_2_um_filter_34_16(N,G)
– Fundort: Crystal Geyser am Green River, Utah, USA(N)
- Referenzstamm CG_4_9_14_0_2_um_filter_34_16(N,G)
- Spezies Nitrosopumilus sp003702465(G) [Ca. Nitrosomarinus sp. isolate GoM_MAG2(N)] – nach der GTDB hierher verschoben
- Referenzstamm GoM_MAG2(N,G)
– Fundort: Meerwasser des Festlandsockels, Golf von Kalifornien, Mexiko(N) - Stämme 3um_C4Z0729_1.33; …(G)
- Referenzstamm GoM_MAG2(N,G)
- Spezies Nitrosopumilus sp003702495(G) [Nitrosopumilus sp. isolate GoM_MAG4(N)]
- Referenzstamm GoM_MAG4(N,G)
– Fundort: Meerwasser des Festlandsockels, Golf von Kalifornien, Mexiko(N) - Stämme 33_1; …(G)
- Referenzstamm GoM_MAG4(N,G)
- Spezies Nitrosopumilus sp003702525(G) [Nitrosopumilus sp. isolate GoM_MAG5(N)]
- Referenzstamm GoM_MAG5(N,G)
– Fundort: Meerwasser des Festlandsockels, Golf von Kalifornien, Mexiko(N)
- Referenzstamm GoM_MAG5(N,G)
- Spezies Nitrosopumilus sp003702545(G) [Nitrosopumilus sp. isolate GoM_MAG6(N)]
- Referenzstamm GoM_MAG6(N,G)
– Fundort: Meerwasser des Festlandsockels, Golf von Kalifornien, Mexiko(N)
- Referenzstamm GoM_MAG6(N,G)
- Spezies Nitrosopumilus sp014078525(G) [inkl. Nitrosopumilus sp. b3(N)]
- Referenzstamm b3
– Fundort: Ozeanwasser um Florida(N)
- Referenzstamm b3
- Spezies Nitrosopumilus sp006740685(G) [Nitrosopumilus sp. SW(N), Ca. Nitrosopumilus sp. SW(N,W)[19]]
- Referenzstamm SW(N,G)
– Fundort: Marine Wassersäule bei Südkorea(N)
- Referenzstamm SW(N,G)
- Spezies Nitrosopumilus sp…(G)
- Spezies Nitrosopumilus sp. AR(N)
- Referenzstamm AR(N,G)
– Fundort: Arktischer Ozean um Spitzbergen(N)
- Referenzstamm AR(N,G)
- Spezies Nitrosopumilus sp. BACL13 MAG-120910-bin56(N)
- Rerenzstamm BACL13 MAG-120910-bin56(N,G)
– Fundort: brackiges Oberflächenwasser vor Öland, Ostsee(N)
- Rerenzstamm BACL13 MAG-120910-bin56(N,G)
- Spezies Nitrosopumilus sp. BC – Anreicherungskultur, siehe Jong-Geol Kim et al. (2019), Fig. S1[19]
- Referenzstamm BC[19]
- Spezies Nitrosopumilus sp. Casp-thauma1 [Thaumarchaeota archaeon casp-thauma1(N)] (evtl. identisch mit Ca. N. limneticus)[22]
- Referenzstamm Casp-thauma1(N,G)
– Fundort: Kaspisches Meer
- Referenzstamm Casp-thauma1(N,G)
- Spezies Nitrosopumilus sp. CG10_big_fil_rev_8_21_14_0_10_33_7(N)
- Referenzstamm CG10_big_fil_rev_8_21_14_0_10_33_7(N,G)
– Fundort: Green River, Utah, USA(N)
- Referenzstamm CG10_big_fil_rev_8_21_14_0_10_33_7(N,G)
- Spezies Nitrosopumilus sp. DDS1(N), [Ca. Nitrosopumilus sp. DDS1(N)[19]]
- Referenzstamm DDS1(N,G)
– Fundort: Wassersäule im Ozean östlich von Südkorea
- Referenzstamm DDS1(N,G)
- Spezies Nitrosopumilus sp. (ex Thoosa mismalolli)(N)
- Referenzsztamm NMAG03(G,N) alias JAJTIH000000000(N) (Zugriffsnummer)
– Fundort: (südlich der) Isabel Island,[30] Pazifik vor Mexiko, Wirt: Schwamm Thoosa mismalolli(N)
- Referenzsztamm NMAG03(G,N) alias JAJTIH000000000(N) (Zugriffsnummer)
- Spezies Nitrosopumilus sp. K4(N)
- Referenzstamm K4
– Fundort: Strand, Südkorea(N)
- Referenzstamm K4
- Spezies Ca. Nitrosopumilus sp. MTA1(N)
- Referenzstamm K4
– Fundort: Marianengraben, Pazifik
- Referenzstamm K4
- Spezies Nitrosopumilus sp. PRT-SC01(N)
- Referenzstamm PRT-SC01(N,G)
– Fundort: Hadopelagische Wassersäule vom Puerto-Rico-Graben in 8200 m Tiefe(N)
- Referenzstamm PRT-SC01(N,G)
- Spezies Nitrosopumilus sp. RSA3(N)
- Referenzstamm PRT-SC01(N)
– Fundort: Sole-Salzwasser-Übergangsschicht (Halokline) eines Solebeckens (engl. brine lake) im roten Meer(N)
- Referenzstamm PRT-SC01(N)
- Spezies Nitrosopumilus sp. UBA241(N)
- Referenzstamm UBA241(N,G)
– Fundort: Wassersäule, Ostsee
- Referenzstamm UBA241(N,G)
- Spezies Nitrosopumilus sp. YT1(N)
- Referenzstamm YT1(N,G)
– Fundort: Yapgraben (engl. Yap Trench, YT)(N)
- Referenzstamm YT1(N,G)
- Spezies Nitrosopumilus sp. JGI 01_H8(N)
- Spezies Nitrosopumilus sp. JGI 01_L6(N)
- Spezies Nitrosopumilus sp. JGI 01_M11(N)
- Spezies Nitrosopumilus sp. SCGC AG-485_D14(N)
- Spezies Nitrosopumilus sp. SCGC AG-485_G10(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_A10(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_C03(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_E18(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_K17(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_L18(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_N15(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_O16(N)
- Spezies Nitrosopumilus sp. SCGC AG-487_O18(N)
- Spezies Thaumarchaeota archaeon SCGC AD-311-O21(Z)
- Spezies Thaumarchaeota archaeon SCGC AD-305-F05-v2(Z)
- Spezies Thaumarchaeota archaeon SCGC AAA282-K18(Z)
- Spezies Nitrosopumilus sp. SP17(N)
Verschiebungen
Nach der GTDB gehört folgendes vorgeschlagenes Mitglied eine Gattung mit provisorischer Bezeichnung PXYB01:
- Spezies Nitrosopumilus sp. b1(N) ⇒ PXYB01 sp014078545(G)
Kladogramm
Das folgende Kladogramm wurde vom GTDB-Release 09-RS220 (Genome Taxonomy Database) entlehnt:[31][25]
| Nitrosopumilus |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Etymologie
Der erste Teil des Gattungsnamens Nitrosopumilus leitet sich ab von lateinisch nitrosus, das seinerseits von altgriechisch νίτρον nítron, deutsch ‚Salpeter‘ abstammt, und Nitrate oder Nitrite bezeichnet (Kalisalpeter, Chilesalpeter, nicht zu verwechseln mit Natron oder der Chemikalie Nitron)[32], vgl. Bakteriengattung Nitrosomonas. Der zweite Teil kommt von lat. pumilus ‚Zwerg‘. Der Name kennzeichnet also einen Zwerg, der Nitrat (oder Nitrit) produziert.[9]
- Das Artepitheton der Typusart, maritimus ist ebenfalls lateinisch und bedeutet ‚zum Meer gehörend‘, was den Lebensraum dieser Organismen beschreibt.[9]
- Das Artepitheton cobalaminigenes kommt von Cobalamin (Vitamin B12) und altgr. γεννάω gennaō, deutsch ‚gebären, produzieren, machen‘, ein Hinweis auf die hohen Cobalamin-Erzeugungsraten des Referenzstammes dieser Gattung.[9]
- Das Artepitheton oxyclinae kommt von altgr, ὀξύς oxýs, deutsch ‚scharf, spitz, sauer‘ und κλίνω klinō, deutsch ‚sich beugen, sich neigen‘, lateinisch [de]clinare (vgl. Deklination = Flexion = Beugung). Dies mit Bezug auf die Oxykline (Grenze zwischen Schichten unterschiedlichen Sauerstoffgehalts in der Wassersäule), aus der der Referenzstamm dieser Gattung isoliert wurde.[9]
- Das Artepitheton ureiphilus kommt von lateinisch urea ‚Harnstoff‘ und (latinisiert) von altgr. φίλων phílōn, deutsch ‚liebend‘ bzw. φίλος phílos, deutsch ‚liebend, geliebt, lieb, teuer, angenehm‘,[33] bedeutet also zusammen „harnstoffliebend“.[9]
- Das Artepitheton zosterae ist neulateinischer Genitiv des Gattungsnamens Zostera (Seegräser, en. eelgrass), und bezieht sich auf das Habitat dieser Spezies.[9]
„Nitrosopumilus cobalaminigenes“
Die Zellen dieser Spezies sind gerade kleine Stäbchen von 0,65-1,27 μm Länge und 0,15-0,26 μm Breite. Die Zellen sind nicht motil (nicht beweglich).
Optimales Wachstum bei 0,2-1,0 mᴍ (mmol/ℓ) an Ammonium, wobei Werte von bis zu 10 mᴍ toleriert werden (bei einem pH-Wert von 7,5). Wachstum wird beobachtet bei Temperaturen im Bereich von 10-30 °C (optimal 25 °C) und einem Salzgehalt von 15-40 ‰ (optimal 32 ‰). Unter günstigsten Bedingungen erfolgt eine Zweiteilung (Verdopplung der Zellzahl) alle 30 Stunden. Die Zellen sind lichtempfindlich und können durch gewöhnliche Tages-Nacht-Zyklen bei ausreichender Lichtintensität in der Tagesphase vollständig am Wachstum gehemmt werden.
Diese Archaeen besitzen keine Urease. Cobalamin (Vitamin B12) wird erzeugt bis zu einer hohen Konzentration von 9300 – 11600 nmol B12 pro Mol Zellkohlenstoff, worauf das Namensepitheton hinweist.
Der Referenzstamm HCA1T (alias ATCC:TSD-96T) wurde aus Salzwasser in einer Tiefe von 50 m im Hood Canal am Puget Sound im US-Bundesstaat Washington isoliert.
Die DNA des Genoms hat einen G+C-Gehalt von 33,0 mol% (Referenzstamm).[7]
„Nitrosopumilus oxyclinae“
Die Zellen dieser Spezies sind Stäbchen von 0,69-0,93 μm Länge und 0,17-0,26 μm Breite. Die Zellen sind nicht motil (nicht beweglich).
Sie tolerieren Ammonium in relativ hohen Konzentrationen von bis zu 1 mM (mmol/ℓ) bei einem pH-Wert von 7,5. Sie wachsen bei einem pH-Wert von 6,4-7,8 (optimal 7,3), Temperaturen zwischen 4 und 30 °C (optimal 30 °C) und einem Salzgehalt von 10-40 ‰ (optimal 25 ‰) Unter günstigsten Bedingungen erfolgt eine Zweiteilung (Verdopplung der Zellzahl) alle 33 Stunden.
Diese Archaeen besitzen keine Urease. Die Zellen sind zur Synthese von Cobalamin (Vitamin B12) fähig, wobei die erreichten Konzentrationen bei 4200 – 5300 nmol B12 pro Mol Zellkohlenstoff liegen.
Der Referenzstamm HCE1T (alias ATCC:TSD-98T) wurde aus Salzwasser in einer Tiefe von 17 m im Hood Canal am Puget Sound im US-Bundesstaat Washington isoliert.
Die DNA des Genoms hat einen G+C-Gehalt von 33,1 mol% (Referenzstamm).[7]
„Nitrosopumilus ureiphilus“
Die Zellen dieser Spezies sind gerade oder leicht gebogene Stäbchen von 0,76-1,59 μm Länge und 0,22-0,26 μm Breite. Die Zellen sind nicht motil (nicht beweglich), obwohl Gene für ein Archaeen-Flagellum (Geißel) und Chemotaxis bedeuten könnten, dass die Zellen unter bestimmten Bedingungen bewegungsfähig sind.
Die maximale Ammoniumtoleranz beträgt 20 mM (mmol/ℓ) bei einem pH-Wert von 7,5. Die Zellen wachsen am besten bei einer normalen Sauerstoff-Konzentration von 21 %, sie oxidieren aber auch bei sehr geringen Sauerstoffkonzentrationen weiterhin aktiv Ammoniak und teilen sich.
Der optimale pH-Wert liegt bei 6,8, aber die Zellen wachsen auch noch bei einem pH-Wert von 5,9 Wachstum erfolgt bei Temperaturen zwischen 10 uns 30 °C (optimal bei 26 °C) und bei einem Salzgehalt von 15-40 ‰ (optimal 25-32 ‰). Unter günstigsten Bedingungen erfolgt eine Zweiteilung (Verdopplung der Zellzahl) ca. alle 54 Stunden. Die Zellen sind lichtempfindlich und können durch gewöhnliche Tages-Nacht-Zyklen bei ausreichender Lichtintensität in der Tagesphase vollständig am Wachstum gehemmt werden.
Harnstoff kann als Ammoniakquelle für die Energiegewinnung und das Wachstum dienen. Die Zellen sind zur Synthese von Cobalamin (Vitamin B12) fähig, wobei die erreichten Konzentrationen bei 4700 – 5900 nmol B12 pro Mol Zellkohlenstoff liegen.
Der Referenzstamm PS0T (alias ATCC:TSD-99T) wurde aus einem küstennahen Oberflächensediment am Puget Sound im US-Bundesstaat Washington isoliert.
Die DNA des Genoms hat einen G+C-Gehalt von 33,4 mol% (Referenzstamm).[7]
Nitrosopumilus zosterae
Der Referenzstamm NM25T wurde aus Sedimenten der Seegraszone der Küste von Shimoda (Izu-Halbinsel, Präfektur Shizuoka, Japan) isoliert. Die Zellen sind stäbchenförmig und haben eine S-förmige Zellwand. Der Temperaturbereich für das Wachstum liegt zwischen 20 und 37 °C (optimal bei 30° C); der pH-Bereich liegt zwischen 6,1 und 7,7 (optimal bei 7,1); der Salinitätsbereich (Salzkonzentration) für das Wachstum liegt bei 5–40 % (optimal bei ca. 15–32 %. Die Zellen beziehen ihre Energie aus der Oxidation von Ammoniak und nutzten Bikarbonat als Kohlenstoffquelle; eine Verwertung von Harnstoff wurde nicht beobachtet. Der Stamm NM25T benötigte einen Wasserstoffperoxid-Scavenger (Abfänger) wie α-Ketoglutarat, Pyruvat oder Katalase für ein anhaltendes Wachstum auf Ammoniak. Einige organische Verbindungen oder Mischungen derselben können das Wachstum von NM25T bereits in niedrigen Konzentrationen hemmen, darunter Glycerin, Pepton und Hefeextrakt. Die phylogenetische Analyse zeigte 2021, dass der engste Verwandte Nitrosopumilus ureiphilus (Stamm PS0T) ist, mit Sequenzähnlichkeiten von 99,5 % für die 16S-rRNA und 97,2 % für das amoA-Gen.[25]
„Nitrosopumilus sp006740685“ [„Ca. Nitrosopumilus sp. SW“]
Der Nitrosopumilus-Stamm SW (‚Surface water‘, im Taxonomy Browser des National Center for Biotechnology Information – NCBI – und im und World Register of Marine Species – WoRMS – als nicht-klassifizierte Spezies N. sp. SW[34] bzw. Ca. N. sp. SW[12] gelistet, in der GTDB der Spezies Nitrosopumilus sp006740685 zugeordnet) wurde aus dem Gelben Meer bei Südkorea isoliert. Sein Gen für das Protein amoA (ammonia monooxygenase subunit A) und seine 16S-rRNA wurden (teilweise) sequenziert (Kim, 2016). Diese Untersuchungen legen offenbar nahe, dass die Wasserstoffperoxid-Entgiftung ein Schlüsselmechanismus für das Wachstum mariner Ammoniak-oxidierender Archaeen ist.[35][36]
Nach einer in PNAS veröffentlichten Studie von Kim et al. (2019)[19] clustert der Stamm SW mit den beiden Stämmen SCM1 und NAOA6 von Nitrosopumilus maritimus (siehe Supplement, Fig. S1),[19] könnte also möglicherweise derselben Spezies angehören (statt wie beim NCBI und bei der WoRMS provisorisch angenommen eine eigene Spezies zu bilden).
Viren

Archaeen der Gattung Nitrosopumilus werden von Viren der Familie Thaspiviridae parasitiert, darunter befinden sich eine Reihe von Stämmen oder Isolaten, die englisch als Nitrosopumilus spindle-shaped viruses (NSVs) bezeichnet werden. Nach der in PNAS veröffentlichten Studie von Kim et al. (2019) infizieren die Virenstämme NSV1, NSV2 und NSV3 aus Proben von der Westküste der koreanischen Halbinsel den Nitrosopumilus-Stamm SW.[19] Die Viruspartikel (Virionen) dieser NSVs sind spindel- oder zitronenförmig bei einem Durchmesser von 64 ± 3 nm und einer Länge von 112 ± 6 nm in der Länge, mit einem kurzen Schwanz an einem der beiden Pole. Die morphologischen Merkmale dieser NSVs sind damit denen von Viren der Familien Fuselloviridae und Halspiviridae, die hyperthermophile bzw. hyperhalophile Archaeen infizieren, sehr ähnlich.[19]
Im (angenommenen) Vorschlag von Kim et al. (2019) an des International Committee on Taxonomy of Viruses (ICTV) heißt es aber, dass NSV1, NSV2 und NSV3 gerade den Referenzstamm SCM1 von Nitrosopumilus maritimus infizieren.[37] Das ICTV hat 2020 für diese Stämme die gemeinsame Virusspezies Nitmarvirus NSV1 (inzwischen umbenannt in Nitmarvirus maris) geschaffen, monotypisch in der Gattung Nitmarvirus der Familie Thaspiviridae[38] (aktueller Stand Januar 2022).[39] Dies löst eine ältere Klassifizierung der Virusgattung als Mitglied der Gattung Alphafusellovirus (Familie Fuselloviridae)[40] ab und wird mit dafür ausreichenden Unterschieden im Genom der beiden Virusgattungen begründet.[37] In Detail (Stand 21. Juli 2025):
- Nitrosopumilus spindle-shaped virus 1 (Spezies Nitmarvirus maris, früher Nitmarvirus NSV1), mit Isolaten
- NSV1 (Exemplar, d. h. Rferenz)
- NSV2
- NSV3
Über diese drei Viren – beim NCBI als Isolate bezeichnet – hinaus sind dort noch weitere NSVs (Nitrosopumilus spindle-shaped viruses) aufgeführt: NSV4 bis NSV7 (Stand 1. Februar 2022).[40]
Der Unterschied in der Virusanfälligkeit selbst einander nahestehender Nitrosopumilus-Stämme kann durch geringfügige Unterschiede bedingt sein, wie etwa verschieden gut wirkende Abwehrmechanismen der Archaeen oder das Vorhandensein spezifischer Virusrezeptoren an der Oberfläche der Archaeenzellen.[19]
Viren als Parasiten Ammoniak-oxidierende Archaeen (AOA) sind zwar noch wenig erforscht (Stand 2019). Der AOA sind jedoch bedeutende Akteure im globalen Stickstoffkreislauf, und daher stellen NSVs eine potenziell wichtige Gruppe mariner Viren dar. Die weite Verbreitung von NSVs in AOA-haltigen Meeresumgebungen deutet darauf hin, dass diese Parasiten die Vielfalt und Dynamik von AOA-Gemeinschaften regulieren und dadurch den Kohlenstoff- und Stickstoffkreislauf beeinflussen. Darüber hinaus bieten die NSVs wichtige Einblicke in die Vielfalt und Evolution der Virosphäre der Archaeenviren.[19]
Anmerkungen
Weiterführende Literatur und Weblinks
- William W. Metcalf, Benjamin M. Griffin, Robert M. Cicchillo, Jiangtao Gao, Sarath Chandra Janga, Heather A. Cooke, Benjamin T. Circello, Bradley S. Evans, Willm Martens-Habbena, David A. Stahl, Wilfred A. van der Donk: Synthesis of Methylphosphonic Acid by Marine Microbes: A Source for Methane in the Aerobic Ocean. In: Science. 337. Jahrgang, Nr. 6098, 31. August 2012, S. 1104–1107, doi:10.1126/science.1219875, PMID 22936780, PMC 3466329 (freier Volltext), bibcode:2012Sci...337.1104M (englisch)..
- Christoph Reitschuler, Philipps Lins, Andreas Otto Wagner, Paul Illmer: Cultivation of moonmilk-born non-extremophilic Thaum and Euryarchaeota in mixed culture. In: Anaerobe. 29. Jahrgang, Nr. 1, Oktober 2014, S. 73–79, doi:10.1016/j.anaerobe.2013.10.002, PMID 24513652 (englisch).
Einzelnachweise
- ↑ Melina Kerou, Pierre Offre, Luis Valledor, Sophie S. Abby, Michael Melcher, Matthias Nagler, Wolfram Weckwerth, Christa Schleper: Proteomics and comparative genomics of Nitrososphaera viennensis reveal the core genome and adaptations of archaeal ammonia oxidizers. In: PNAS, Band 113, Nr. 49, 6. Dezember 2016, S. E7937–E7946; doi:10.1073/pnas.1601212113, PMC 5150414 (freier Volltext), PMID 27864514 (englisch).
- ↑ NCBI Taxonomy Browser: Nitrosopumilales, Details: Nitrosopumilales Qin et al. 2017, heterotypic synonyms: "Nitrosopumilales" Konneke et al. 2005; …; marine archaeal group 1; …). Graphisch: Nitrosopumilales. Auf: Lifemap (cnrs.fr).
- ↑ OneZoom: Marine Group I.
- ↑ Christopher B. Walker, José R. de la Torre, M. G. Klotz, Hidetoshi Urakawa, N. Pinel, Daniel J. Arp, Céline Brochier-Armanet, P. S. G. Chain, P. P. Chan, A. Gollabgir, J. Hemp, M. Hügler, E. A. Karr, M. Könneke, M. Shin, T. J. Lawton, T. Lowe, W. Martens-Habbena, L. A. Sayavedra-Soto, D. Lang, S. M. Sievert, A. C. Rosenzweig, G. Manning, D. A. Stahl: Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea. In: PNAS, Band 107. Nr. 19, 11. Mai 2010, S. 8818–8823, ISSN 1091-6490, bibcode:2010PNAS..107.8818W; doi:10.1073/pnas.0913533107, PMC 2889351 (freier Volltext), PMID 20421470, Epub 26. April 2010 (englisch).
- ↑
Beate Kraft, Nico Jehmlich, Morten Larsen, Laura A. Bristow, Martin Könneke, Bo Thamdrup, Donald E. Canfield: Oxygen and nitrogen production by an ammonia-oxidizing archaeon. In: Science. 375. Jahrgang, Nr. 6576, 7. Januar 2022, ISSN 0036-8075, S. 97–100, doi:10.1126/science.abe6733 (englisch). Dazu:
- David Nield: Microbes in The Ocean Depths Can Make Oxygen Without Sun. This Discovery Could Be Huge. Auf: sciencealert vom 11. Januar 2022;
- Daniel Lingenhöhl: Leben in der Tiefsee: Sauerstoff ohne Fotosynthese. Auf: spektrum.de vom 7. Januar 2022;
- Martin Vieweg: Überraschender Befund: Sauerstoffproduktion in dunkler Tiefe. Auf: wissenschaft.de vom 10. Januar 2022.
- ↑ a b c
Martin Könneke, Anne E. Bernhard, José R. de la Torre, Christopher B. Walker, John B. Waterbury, David A. Stahl: Isolation of an autotrophic ammonia-oxidizing marine archaeon. In: Nature. 437. Jahrgang, Nr. 7058, 22. September 2005, ResearchGate:7585770, S. 543–546, doi:10.1038/nature03911, PMID 16177789, bibcode:2005Natur.437..543K (englisch). Siehe insbes.:
- Fig. 1 (Phylogenie),
- Fig. 2 (Aufnahme von N. maritimus, Stamm SCM1).
- ↑ a b c d e f g h i j k l m Wei Qin, Katherine R. Heal, Rasika Ramdasi, Julia N. Kobelt, Willm Martens-Habbena, Anthony D. Bertagnolli, Shady A. Amin, Christopher B. Walker, Hidetoshi Urakawa, Martin Könneke, Allan H. Devol, James W. Moffett, E. Virginia Armbrust, Grant J. Jensen, Anitra E. Ingalls, David A. Stahl: Nitrosopumilus maritimus gen. nov., sp. nov., Nitrosopumilus cobalaminigenes sp. nov., Nitrosopumilus oxyclinae sp. nov., and Nitrosopumilus ureiphilus sp. nov., four marine ammonia-oxidizing archaea of the phylum Thaumarchaeota. In: International Journal of Systematic and Evolutionary Microbiology, Band 67, Nr. 12, 1. Dezember 2017, S. 5067-5079; doi:10.1099/ijsem.0.002416, PMID 29034851, Epub 16. Oktober 2017 (englisch).
- ↑ a b c Barbara Bayer, Jana Vojvoda, Thomas Reinthaler, Carolina Reyes, Maria Pinto, Gerhard J. Herndl: Nitrosopumilus adriaticus sp. nov. and Nitrosopumilus piranensis sp. nov., two ammonia-oxidizing archaea from the Adriatic Sea and members of the class Nitrososphaeria. In: International Journal of Systematic and Evolutionary Microbiology, Band 69, 2019, S. 1892–1902; doi:10.1099/ijsem.0.003360 (englisch).
- ↑ a b c d e f g h Jean P. Euzéby, Aidan C. Parteet al.: Nitrosopumilus Qin et al. Auf: List of Prokaryotic names with Standing in Nomenclature (LPSN).
- ↑ NCBI Taxonomy Browser: Nitrosopumilus, Details: Nitrosopumilus Qin et al. 2017; homotypic synonym: "Nitrosopumilus" Konneke et al. 2005. Graphisch: Nitrosopumilus. Auf: Lifemap (cnrs.fr).
- ↑ GTDB: Nitrosopumilus.
- ↑ a b WoRMS: Nitrosopumilus Könneke, Bernhard, de la Torre, Walker, Waterbury & Stahl, 2005 (Genus).
- ↑ Dayu Zou, Ru Wan, Lili Han, Min Nina Xu, Yang Liu, Hongbin Liu, Shuh-Ji Kao, Meng Li: Genomic Characteristics of a Novel Species of Ammonia-Oxidizing Archaea from the Jiulong River Estuary. In: Applied and Environmental Microbiology, Band 86, Nr. 18, 1. September 2020, S. e00736-20; doi:10.1128/AEM.00736-20, PMC 7480389 (freier Volltext), PMID 32631866 (englisch). Siehe insbes. Fig. 3 and Fig. 4.
- ↑ a b NCBI Taxonomy Browser: Candidatus Nitrosomarinus, Detail: "Candidatus Nitrosomarinus" Ahlgren et al. 2017 (genus). National Center for Biotechnology Information (NCBI) taxonomy database. Graphisch: Candidatus Nitrosomarinus. Auf: Lifemap (cnrs.fr).
- ↑ a b Anna N. Rasmussen, Christopher A. Francis, Rachel Poretsky: Genome-Resolved Metagenomic Insights into Massive Seasonal Ammonia-Oxidizing Archaea Blooms in San Francisco Bay. In: ASM: mSystems, Band 7, Nr. 1, 25. Januar 2022, S. e01270-21; doi:10.1128/msystems.01270-21 (englisch).
- ↑ a b c d e f g h i j k l m n o p q Shan Zhang, Weizhi Song, Bernd Wemheuer, Julie Reveillaud, Nicole Webster, Torsten Thomas: Comparative Genomics Reveals Ecological and Evolutionary Insights into Sponge-Associated Thaumarchaeota. In: mSystems, Band 4, Nr. 4, 13. August 2019, S. e00288-19; doi:10.1128/msystems.00288-19, PMC 6697440 (freier Volltext), PMID 31409660 (englisch).
- ↑ Piranski Zaliv. Auf: GeoNames.
- ↑ Salepo Island. GeoNames.
- ↑ a b c d e f g h i j k Jong-Geol Kim, So-Jeong Kim, Virginija Cvirkaite-Krupovic, Woon-Jong Yu, Joo-Han Gwak, Mario López-Pérez, Francisco Rodriguez-Valera, Mart Krupovic, Jang-Cheon Cho, Sung-Keun Rhee: Spindle-shaped viruses infect marine ammonia-oxidizing thaumarchaea. In: PNAS, Band 116, Nr. 31, 30. Juli 2019, S. 15645-15650; doi:10.1073/pnas.1905682116, ResearchGate:334498162, Epub 16. Juli 2019. Siehe auchp 1; …). Graphisc Supplement, insbes. Kladogramm Fig. S1.
- ↑ a b Soo-Je Park, Jong-Geol Kim, Man-Young Jung, So-Jeong Kim, In-Tae Cha, Kaekyoung Kwon, Jung-Hyun Lee, Sung-Keun Rhee: Draft genome sequence of an ammonia-oxidizing archaeon, "Candidatus Nitrosopumilus koreensis" AR1, from marine sediment. In: Journal of Bacteriology, Band 194, Nr. 24, Dezember 2012, S. 6940-6941; doi:10.1128/JB.01857-12, PMC 3510587 (freier Volltext), PMID 23209206 (englisch).
- ↑ OneZoom: Candidatus Nitrosopumilus koreensis AR1
- ↑ a b c d
Franziska Klotz, Katharina Kitzinger, David Kamanda Ngugj, Petra Büsing, Sten Littmann Marcel, M. M. Kuypers, Bernhard Schink, Michael Pester: Quantification of archaea-driven freshwater nitrification from single cell to ecosystem levels. In: Nature: The ISME Journal, Band 16, Nr. 6, 8. März 2022; doi:10.1038/s41396-022-01216-9 (englisch). Dazu:
- Josephine Franke: Bodensee: Urzeit-Mikroben sichern Trinkwasserversorgung. Neuentdeckte Archaeen-Spezies baut Ammonium-Überschuss ab. Auf: scinexx.de vom 21. März 2022.
Anm.: Im scinexx-Artikel wird die Klasse Nitrososphaeria fehlerhaft als Gattung bezeichnet..
- Josephine Franke: Bodensee: Urzeit-Mikroben sichern Trinkwasserversorgung. Neuentdeckte Archaeen-Spezies baut Ammonium-Überschuss ab. Auf: scinexx.de vom 21. März 2022.
- ↑ OneZoom: Nitrosopumilus maritimus SCM1.
- ↑ Yangkai Zhou, An Yan, Jiawen Yang, Wei He, Shuai Guo, Yifan Li, Jing Wu, Yanchao Dai, Xijiang Pan, Dongyu Cui, Olivier Pereira, Wenkai Teng, Ran Bi, Songze Chen, Lu Fan, Peiyi Wang, Yan Liao, Wei Qin, Sen-Fang Sui, Yuanqing Zhu, Chuanlun Zhang, Zheng Liu: Ultrastructural insights into cellular organization, energy storage and ribosomal dynamics of an ammonia-oxidizing archaeon from oligotrophic oceans. In: Frontirs in Microbiology, Sec. Biology of Archaea, Band 15, 26 April 202, S. 1367658; doi:10.3389/fmicb.2024.1367658 (englisch).
- ↑ a b c d Tatsunori Nakagawa, Mori Koji, Akira Hosoyama, Atsushi Yamazoe, Yuki Tsuchiya, Shingo Ueda1, Reiji Takahashi, David A. Stahl: Nitrosopumilus zosterae sp. nov., an autotrophic ammonia-oxidizing archaeon of phylum Thaumarchaeota isolated from coastal eelgrass sediments of Japan. In: International Journal of Systematic and Evolutionary Microbiology, Band 71, Nr. 8, 18. August 2021; doi:10.1099/ijsem.0.004961, Epub 18. August 2021 (englisch).
- ↑ Shengshan, Juqi. Auf: Mapcarta (de).
- ↑ Stewart Seamount. Auf: GeoNames.
- ↑ Wangzhen Seamount. Auf: GeoNames.
- ↑ Canada Basin. Auf: GeoNames.
- ↑ Isla Isabel. Auf: GeoNames.
- ↑
Genome Taxonomy Database (GTDB) Release 09-RS220
- About. In: GTDB. Abgerufen am 10. Mai 2024 (englisch).
- ar53_r220.sp_label (Tree). In: GTDB. Abgerufen am 10. Mai 2024.
- Taxon History. In: GTDB. Abgerufen am 10. Mai 2024 (englisch).
- ↑ Nitron, auf: Merck Sigma-Aldrich (sigmaaldrich.com).
- ↑ Wiktionary: φίλος (de), φίλος (en).
- ↑ NCBI Taxonomy Browser: Nitrosopumilus sp. SW (species).
- ↑ NCBI Nucleotide: Nitrosopumilus sp. SW ammonia monooxygenase subunit A (amoA) gene, partial cds. Accession: KU884942. Quelle: Jong-Geol Kim, 8. März 2016.
- ↑ NCBI Nucleotide: Nitrosopumilus sp. SW 16S ribosomal RNA gene, partial sequence. Accession: KU884943. Quelle: Jong-Geol Kim, 8. März 2016.
- ↑ a b Jong-Geol Kim, Mart Krupovic, Sung-Keun Rhee: Thaspiviridae Proposal 2019.092B (zip:docx), Filelist – accepted (englisch).
- ↑ ICTV: ICTV Master Species List 2019.v1, New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35).
- ↑ ICTV: ICTV Master Species List 2020.v1, New MSL including all taxa updates since the 2019 release, March 2021 (MSL #36).
- ↑ a b NCBI Taxonomy Browser: Nitrosopumilus spindle-shaped virus (species); Nucleotide: Nitrosopumilus spindle-shaped virus NSV*.