Natriumhexafluorosilicat
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
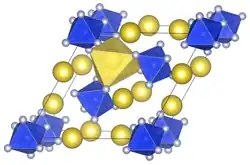
| ||||||||||||||||
| _ Na+ _ Si4+ _ F− | ||||||||||||||||
| Kristallsystem |
trigonal | |||||||||||||||
| Raumgruppe |
P321 (Nr. 150) | |||||||||||||||
| Gitterparameter |
a = 885,9 pm, c = 503,8 pm, Z = 3[1] | |||||||||||||||
| Koordinationszahlen |
[6]Si, [6]Na | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumhexafluorosilicat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | Na2[SiF6] | |||||||||||||||
| Kurzbeschreibung |
farbloser bis weißer, geruch- und geschmackloser Feststoff[3][4] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 188,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
2,68 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,312[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Natriumhexafluorosilicat ist eine chemische Verbindung aus der Gruppe der Natriumverbindungen, Hexafluorosilicate und Fluorokomplexe.
Vorkommen
Natriumhexafluorosilicat kommt natürlich in Form des Minerals Malladrit vor.[6]
Gewinnung und Darstellung
Natriumhexafluorosilicat kann durch Neutralisation von Hexafluoridokieselsäure mit Natriumhydroxid, Natriumcarbonat oder Natriumchlorid gewonnen werden.[4]
Es entsteht auch als Nebenerzeugnis bei der Herstellung von Superphosphaten über Siliziumfluorid.
Eigenschaften
Natriumhexafluorosilicat ist ein farbloser bis weißer, geruch- und geschmackloser Feststoff, welcher schwer löslich in Wasser ist. Bei Erhitzung zersetzt er sich ab etwa 800 °C zu Siliciumtetrafluorid und Natriumfluorid.[3]
Natriumhexafluorosilicat besitzt eine trigonale Kristallstruktur mit a = 885,9 pm, c = 503,8 pm, Z = 3 und der Raumgruppe P321 (Raumgruppen-Nr. 150).[1]
Verwendung
Natriumhexafluorosilicat wird als Geliermittel bei der Schaumgummiherstellung, als Trübungsmittel bei der Emaille - und Milchglasfabrikation, als Insektizid und Rodentizid und zur Herstellung von synthetischem Kryolith verwendet.[3] Es wird weiterhin bei der Herstellung von Beryllium eingesetzt: durch Rösten von Berylliumsalzen mit Natriumhexafluorosilicat bildet sich Berylliumfluorid, welches durch Reaktion mit Magnesium zu Beryllium überführt wird.[7]
Zulassung
In der Europäischen Union ist Natriumhexafluorosilicat nicht als Wirkstoff von Pflanzenschutzmitteln zugelassen.[8] In Deutschland, Österreich und der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[9]
Einzelnachweise
- ↑ a b A. Zalkin, J. D. Forrester, D. H. Templeton: The crystal structure of sodium fluorosilicate. In: Acta Cryst. 17, 1964, S. 1408–1412; doi:10.1107/S0365110X64003516.
- ↑ Eintrag zu SODIUM FLUOROSILICATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- ↑ a b c d e f g h i j Eintrag zu Natriumhexafluorosilikat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu SODIUM SILICOFLUORIDE in der Hazardous Substances Data Bank (via PubChem), abgerufen am 29. Juli 2012.
- ↑ Eintrag zu Disodium hexafluorosilicate in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Mindat: Malladrite
- ↑ Uni-Regensburg: Erdalkalimetalle
- ↑ Verordnung (EG) Nr. 2076/2002 der Kommission vom 20. November 2002 ... (PDF)
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Sodium fluosilicate in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 6. April 2023.
