Natriumgermanat
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
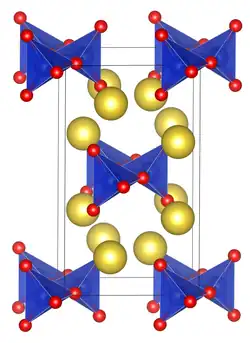
| |||||||||||||||||||
| _ Na+ _ Si4+ _ O2− | |||||||||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||||||||
| Raumgruppe |
Cmc21 (Nr. 36) | ||||||||||||||||||
| Gitterparameter |
a = 1085 pm, b = 622,5 pm, c = 493,0 pm[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumgermanat | ||||||||||||||||||
| Andere Namen |
Natriummetagermanat | ||||||||||||||||||
| Verhältnisformel | Na2GeO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 166,62 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,31 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Natriumgermanat ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Germanate.
Gewinnung und Darstellung
Natriumgermanat kann durch Reaktion von Germanium mit Natriumhydroxid[4] oder durch Reaktion Natriumcarbonat mit Germaniumdioxid bei 1200 °C gewonnen werden.[1]
Eigenschaften
Natriumgermanat ist ein weißer Feststoff, der löslich in Wasser ist.[2] Das Heptahydrat beginnt bei 83 °C sein Kristallwasser zu verlieren.[5] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Cmc21 (Raumgruppen-Nr. 36) isotyp zu Natriummetasilicat.[1]
Einzelnachweise
- ↑ a b c H. Völlenkle, A. Wittmann, H. Nowotny: Verfeinerung der Kristallstruktur des Natriummetagermanats, Na2GeO3. In: Monatshefte für Chemie. 102, 1971, S. 964, doi:10.1007/BF00909922.
- ↑ a b c d Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 487 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Cyril Parsons, Clare Dover: The Elements and their Order: Foundations of Inorganic Chemistry. 1966, S. 89 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 610 (eingeschränkte Vorschau in der Google-Buchsuche).