N-Vinylformamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Vinylformamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5NO | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 71,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,02 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
210 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mit Wasser vollständig mischbar[1] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
N-Vinylformamid (VFA), auch als N-Ethenylformamid bezeichnet, ist ein Amid der Ameisensäure.
Eigenschaften
N-Vinylformamid ist eine klare, fast farblose Flüssigkeit, die mit Wasser beliebig mischbar ist. Die Löslichkeit in polaren organischen Lösungsmitteln ist sehr gut. Im Vakuum ist N-Vinylformamid destillierbar. Bei 13 mbar beträgt der Siedepunkt 84 °C, bei 5 mbar 80 °C. Der berechnete Siedepunkt bei Normaldruck beträgt ca. 210 °C.[6] Unstabilisiert ist es bei Temperaturen oberhalb von 40 °C nicht stabil, da es zur Zersetzung beziehungsweise zur selbstkatalysierten Polymerisation neigt. Bei −10 °C kann es dagegen über ein Jahr unverändert gelagert werden. In wässriger Lösung ist VFA im pH-Bereich 7 bis 8 relativ stabil, während es im Sauren (pH-Wert <4) oder im Alkalischen (pH-Wert >8,5) schnell hydrolysiert.[6]
VFA ist nicht mutagen.[6]
Herstellung
N-Vinylformamid wurde erstmals 1964 – mehr zufällig – synthetisiert.[7] Dabei wurde ursprünglich versucht 2-Formylamino-propionitril durch Pyrolyse zu erhalten. Das gewünschte Produkt reagierte jedoch unter Abspaltung von HCN zu N-Vinylformamid weiter.[6]
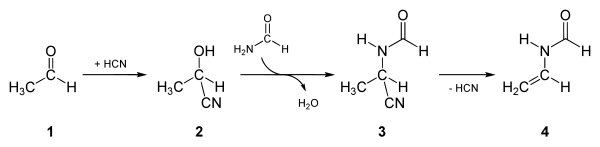
Der weltgrößte Hersteller von VFA ist die BASF in Ludwigshafen am Rhein, die es unmittelbar zu dem vor allem in der Papierindustrie verwendeten Polyvinylamin weiterverarbeitet.[8] In der von diesem Unternehmen entwickelten großtechnischen Synthese wird N-Vinylformamid aus Acetaldehyd und Formamid hergestellt (vgl. auch Abbildung). Zunächst wird dabei Acetaldehyd (1) mit Blausäure zu Milchsäurenitril (2) umgesetzt. An dieses wird unter Wasserabspaltung Formamid kondensiert, so dass 2-Formylamino-propionitril (3) entsteht. Dieses spaltet bei erhöhten Temperaturen Blausäure ab, so dass schließlich N-Vinylformamid (4) entsteht. Die Blausäure geht dabei in den Reaktionskreislauf zurück.
Verwendung
Seit Beginn des 21. Jahrhunderts wird N-Vinylformamid großtechnisch hergestellt. Es dient als Monomer für die Polymerisation zu Polyvinylformamid, das wiederum teilweise oder vollständig zu Polyvinylamin hydrolysiert wird.
Literatur
- W. Auhorn, F. Linhart: Polyvinylamin – Eine neue Klasse von Polymeren für die Papierherstellung mit umweltfreundlichen Eigenschaftsprofil. In: Das Papier 46/1992, S. 38–45.
- W. J. Auhorn: Spezialchemikalien für Spezialpapiere – Chemikalien zur Erzielung multifunktioneller Eigenschaften. In: Wochenblatt für Papierfabrikation 8/1999, S. 505–510.
- Alexander Madl, Stefan Spange, Norbert Mahr: Bromine as an initiator for the oligomerization of vinylformamide (VFA). In: Polymer Bulletin. Band 44, Nr. 1, 2000, S. 39–46, doi:10.1007/s002890050571.
- Torsten Meyer, Stefan Spange, Stephanie Hesse, Christian Jäger, Cornelia Bellmann: Radical Grafting Polymerization of Vinylformamide with Functionalized Silica Particles. In: Macromolecular Chemistry and Physics. Band 204, Nr. 4, 2003, S. 725–732, doi:10.1002/macp.200390042.
- Alexander Madl, Stefan Spange: Synthesis and application of oligo(vinylamine). In: Macromolecular Symposia. Band 161, Nr. 1, 2000, S. 149–158, doi:10.1002/1521-3900(200010)161:13.0.CO;2-P.
Einzelnachweise
- ↑ a b c d e G. Hommel, H. F. Bender: Handbuch der gefährlichen Güter. Springer, ISBN 3-540-20370-2, Merkblatt 2481.
- ↑ Datenblatt N-Vinylformamide bei Sigma-Aldrich, abgerufen am 13. Januar 2021 (PDF).
- ↑ Robert K. Pinschmidt Jr., Walter L. Renz, W. Eamon Carroll, Khalil Yacoub, Jennifer Drescher, A. F. Nordquist, Ning Chen Air Products: N-Vinylformamide – Building Block for Novel Polymer Structures. In: Journal of Macromolecular Science, Part A. Band 34, Nr. 10, 1997, S. 1885–1905, doi:10.1080/10601329708010315.
- ↑ S. Jendrzejewski, W. Steglich: Thermolyse von Oxazolin-5-onen, XI1)N-Acylimine und Enamide durch Gasphasenpyrolyse von 4-Alkyl-2-oxazolin-5-onen. In: Chemische Berichte. Band 114, Nr. 4, 1981, S. 1337–1342, doi:10.1002/cber.19811140412.
- ↑ a b Eintrag zu N-Vinylformamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d e f A. Madl: Die kationisch induzierte Oligomerisation von N-Vinylformamid. Chemnitz 2000, DNB 962394262, urn:nbn:de:bsz:ch1-200000482 (Dissertation, TU Chemnitz).
- ↑ P. Kurtz, H. Disselnkötter: Enamide. In: Justus Liebigs Annalen der Chemie. Band 764, Nr. 1, 1973, S. 69–93, doi:10.1002/jlac.19727640110.
- ↑ Polyvinylformamid und Polyvinylamin ( vom 28. Juni 2007 im Internet Archive). In: Nachrichten aus der Chemie 49/2001.


