Monobromamin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
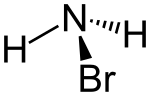
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Monobromamin | ||||||||||||
| Summenformel | NH2Br | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 95,93 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Monobromamin ist eine anorganische Verbindung, die sich aus einer Aminogruppe und einem Bromatom zusammensetzt, also ein Derivat des Ammoniaks, bei dem ein Wasserstoffatom durch Brom ersetzt ist.
Herstellung
Die Herstellung von Monobromamin ist durch Reaktion von elementarem Brom mit überschüssigem Ammoniak in Diethylether unter Kühlung mit Trockeneis möglich. Grundsätzlich kann dabei auch Dibromamin entstehen, jedoch wird durch Zugabe von etwas Cyclohexan direkt nach Mischen der Reagenzien ein weitgehend reines Produkt erhalten.[2] Die Bildung von Monobromamin, Dibromamin und Tribromamin kann in einer solchen Reaktion auch durch Die Mengenverhältnisse von Ammoniak und Brom sowie den pH-Wert gesteuert werden.[3] Eine andere Methode ist die tropfenweise Zugabe von hypobromiger Säure zu einer Lösung von Ammoniumchlorid, wobei letzteres in deutlichem Überschuss eingesetzt wird.[4] Auch die Elektrolyse einer wässrigen Lösung von Ammoniak und Brom ergibt unter geeigneten Bedingungen Monobromamin.[5]
Reaktionen
Monobromamin reagiert mit Grignard-Verbindungen unter Bildung primärer Amine, jedoch in schlechteren Ausbeuten als Monochloramin, da zusätzlich Stickstoff als Nebenprodukt anfällt. Je nach genauem Reaktionspartner sind die Ausbeuten sehr unterschiedlich, die beste Ausbeute mit über 60 % wurde bei Benzylmagnesiumchlorid erzielt. Vergleichsweise gute Ausbeuten zwischen 29 und 46 % ergaben außerdem Butylmagnesiumchlorid, sec-Butylmagnesiumchlorid, tert-Butylmagnesiumchlorid und Phenethylmagnesiumchlorid. Brom- oder iodbasierte Grignard-Verbindungen wie Butylmagnesiumbromid, Butylmagnesiumiodid, tert-Butylmagnesiumbromid oder tert-Butylmagnesiumiodid liefern deutlich geringere Ausbeuten an Amin, ebenso Phenylmagnesiumchlorid.[2]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b George H. Coleman, Harold Soroos, Charles B. Yager: The Reaction of Monobromoamine with Grignard Reagents. In: Journal of the American Chemical Society. Band 55, Nr. 5, Mai 1933, S. 2075–2080, doi:10.1021/ja01332a049.
- ↑ Hend Galal-Gorchev, J. Carrell Morris: Formation and Stability of Bromamide, Bromimide, and Nitrogen Tribromide in Aqueous Solution. In: Inorganic Chemistry. Band 4, Nr. 6, Juni 1965, S. 899–905, doi:10.1021/ic50028a029.
- ↑ Jingxuan Yang, Dongxu Qu, Jue Wang, Yangtao Wu, Lingjun Bu, Yuanxi Huang, Shiqing Zhou: UV-induced degradation of contaminants of emerging concern in the presence of monobromoamine: Role of N-Br bond and degradation mechanisms. In: Journal of Environmental Chemical Engineering. Band 11, Nr. 3, Juni 2023, S. 109646, doi:10.1016/j.jece.2023.109646.
- ↑ C Tremblay-Goutaudier, R Rizk-Ouaini, Mt Cohen-Adad, P Jenin: Monobromamine en milieu aqueux: II. Stabilité et élaboration par voie électrochimique*. In: Journal de Chimie Physique. Band 91, 1994, S. 535–546, doi:10.1051/jcp/1994910535.