Mirvetuximab Soravtansin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
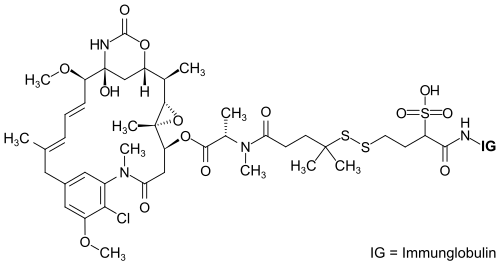
| ||||||||||
| Mirvetuximab-Soravtansin: Das Maytansinoid DM4, gebunden an den monoklonalen Antikörper Mirvetuximab | ||||||||||
| Allgemeines | ||||||||||
| Freiname | Mirvetuximab soravtansin[1] | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | Variabel[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ca. 150 kDa | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Mirvetuximab Soravtansin (Handelsname Elahere) ist ein Arzneistoff zur Behandlung von Krebserkrankungen der Eierstöcke, der Eileiter und des Bauchfells.[4] Strukturell besteht der Wirkstoff aus drei Komponenten. Darin ist der gegen das Protein Folat-Rezeptor alpha (FRα) gerichtete monoklonale Antikörper Mirvetuximab mit dem Zellgift Maytansinoid DM4 über einen Linker kovalent verknüpft.
Das Medikament ist nur wirksam, wenn die Krebszellen relevante Mengen des Proteins Folat-Rezeptor alpha an ihrer Oberfläche aufweisen.
Die häufigsten Nebenwirkungen sind Sehbeeinträchtigungen, Erschöpfung, Durchfall oder Verstopfung, Übelkeit und Bauchschmerzen. Typische Laborveränderungen sind erhöhte Leberenzyme und verminderte Spiegel von Albumin, Hämoglobin, Magnesium und Leukozyten im Blut.[4]
Die erstmalige Zulassung für Mirvetuximab Soravtensin erfolgte im November 2022 in den USA über ein beschleunigtes Zulassungsverfahren der Food and Drug Administration (FDA).[4] Die Zulassung in der EU erfolgte im November 2024.[5] Mirvetuximab Soravtensin ist das erste Medikament, welches sich gegen den Folat-Rezeptor alpha richtet (first-in-class Medikament).
Medizinische Anwendung
Die Zulassung in den USA richtet sich an erwachsene Patienten und Patientinnen mit Folat-Rezeptor-alpha-positivem, Platin-resistentem Eierstock-, Eileiter- und Bauchfellkrebs.[4][6] Zuvor sollten ein bis drei systemische Behandlungsansätze durchgeführt werden. Vor Verabreichung des Medikaments muss mittels eines spezifischen Tests untersucht werden, ob die Krebszellen hinreichend hohe Werte des Folat-Rezeptors alpha an ihrer Oberfläche aufweisen.
Klinische Prüfung
Die Wirksamkeit und Sicherheit von Mirvetuximab Soravtansin wurden in der SORAYA-Studie untersucht.[7][6] Dabei wurden 105 Patienten und Patientinnen einbezogen, welche ein bis drei vorherige Therapieansätze vollzogen hatten und deren Tumoren Folat-Rezeptor-alpha-positiv waren. Eine vorherige Therapie mit Bevacizumab war ebenfalls Voraussetzung. Bei etwa 27 % der Studienteilnehmer wurde eine teilweise Tumorreduktion nachgewiesen. Weitere 5 % zeigten innerhalb des Beobachtungszeitraums von rund 13 Monaten eine vollständige Remission. Die Nebenwirkungen von Sehbeeinträchtigungen und Übelkeit führten in 20 % der Fälle zu Dosisreduktion und in etwa 10 % der Fälle zu einem vorzeitigen Abbruch der Therapie.
Die MIRASOL-Studie verglich die Wirksamkeit von Mirvetuximab Soravtansin mit einem Chemotherapeutikum (Paclitaxel, pegyliertes liposomales Doxorubicin oder Topotecan) bei Patienten mit FRα-positivem, platinresistentem, hochgradigem serösem Ovarialkarzinom, die zuvor ein bis drei systemische Therapien erhalten hatten. Folgende signifikanten Vorteile von Mirvetuximab Soravtansin gegenüber Chemotherapeutikum wurden dabei verzeichnet: Erhöhung der progressionsfreien Überlebenszeit (im Mittel um 1,64 Monate), Erhöhung des Gesamtüberlebens (im Mittel um 3,71 Monate) und ein günstigeres Nebenwirkungsprofil.[8]
Siehe auch
Einzelnachweise
- ↑ INN Recommended List 75, World Health Organisation (WHO), 9. März 2016.
- ↑ Formelstamm: C6482H10006N1714O2022S44 · 2 Oligosaccharid-Reste · (C42H59ClN3O14S3)n (n ≈ 3,4)
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d FDA grants accelerated approval to mirvetuximab soravtansine-gynx for FRα positive, platinum-resistant epithelial ovarian, fallopian tube, or peritoneal cancer. In: U.S. Food and Drug Administration. 14. November 2022, abgerufen am 18. November 2022 (englisch).
- ↑ Union Register of medicinal products. In: ec.europa.eu. 4. März 2025, abgerufen am 26. März 2025 (englisch).
- ↑ a b Ursula A. Matulonis, Domenica Lorusso, Ana Oaknin, Sandro Pignata, Andrew Dean, Hannelore Denys, Nicoletta Colombo, Toon Van Gorp, Jason A. Konner, Margarita Romeo Marin, Philipp Harter, Conleth G. Murphy, Jiuzhou Wang, Elizabeth Noble, Brooke Esteves, Michael Method, Robert L. Coleman: Efficacy and Safety of Mirvetuximab Soravtansine in Patients With Platinum-Resistant Ovarian Cancer With High Folate Receptor Alpha Expression: Results From the SORAYA Study. In: Journal of Clinical Oncology. 30. Januar 2023, S. JCO.22.01900, doi:10.1200/JCO.22.01900.
- ↑ Wirksamkeit und Sicherheit von Mirvetuximab-Soravtansin bei Eierstockkrebs – Arznei-News. Abgerufen am 1. April 2023 (deutsch).
- ↑ Kathleen N. Moore, Antoine Angelergues, Gottfried E. Konecny, Yolanda García García, Susana Banerjee, Domenica Lorusso, Jung‐Yun Lee, John W. Moroney, Nicoletta Colombo, A. Roszak, Jacqueline M. Tromp, Tashanna Myers, Jeong‐Won Lee, Mario Beiner, Casey Cosgrove, David Cibula, Lainie P. Martin, Renaud Sabatier, Joseph Buscema, Purificación Estévez-García, Lan Coffman, Shibani Nicum, Linda Duska, Sandro Pignata, Fernando Gálvez, Yuemei Wang, Michael Method, Anna Berkenblit, Diana Bello Roufai, Toon Van Gorp: Mirvetuximab Soravtansine in FRα-Positive, Platinum-Resistant Ovarian Cancer. In: New England Journal of Medicine. 2023, Band 389, Nummer 23, S. 2162–2174. doi:10.1056/NEJMoa2309169.