Methylsulfat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
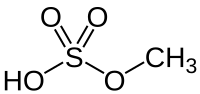
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methylsulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CH4O4S | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 112,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
135 °C[1] | ||||||||||||||||||
| Löslichkeit |
sehr leicht löslich in Wasser, Diethylether und Ethanol[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Methylsulfat ist der Mono-Ethylester der Schwefelsäure mit der Summenformel CH4O4S.
Gewinnung und Darstellung
1993 wurde entdeckt, dass Quecksilberverbindungen die Reaktion von Methan zu Methylsulfat in konzentrierter Schwefelsäure katalysieren, wobei sowohl eine hohe Selektivität als auch hohe Ausbeuten erzielt werden.[3]
Fünf Jahre später wurden Platinkomplexe entdeckt, die eine Umsetzung von Methan mit Schwefeltrioxid und Sauerstoff zu Methylsulfat ermöglichen:[4][5][6]
Diese Entdeckung wies auf die Möglichkeit hin, auch Methan als Hauptkomponente von Erdgas in Methanol umzuwandeln.[7]
Methylsulfat entsteht daneben als Zwischenprodukt bei der Hydrolyse von Dimethylsulfat neben Methanol:[8]
Verwendung
Die konjugierte Base von Methylsulfat wird als Gegenion bei der Herstellung einiger Arzneimittel genutzt.[9]
Einzelnachweise
- ↑ a b c d CRC Handbook of Chemistry and Physics, 85th Edition. Taylor & Francis, ISBN 978-0-8493-0485-9, S. 671 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Ambeed: 75-93-4|Methyl sulfate| Ambeed, abgerufen am 15. November 2024
- ↑ R.A. Periana, D.J. Taube, E.R. Evitt, D.G. Loffler, P.R. Wentrcek, G. Voss, T. Masuda: A Mercury-Catalyzed, High-Yield System for the Oxidation of Methane to Methanol. In: Science. Nr. 5093, 1993, S. 340–343, doi:10.1126/SCIENCE.259.5093.340, PMID 17832346 (englisch).
- ↑ I. H. Hristov, T. Ziegler: The Possible Role of SO3 as an Oxidizing Agent in Methane Functionalization by the Catalytica Process. A Density Functional Theory Study. In: Organometallics. Nr. 8, 2003, S. 1668–1674, doi:10.1021/om020774j (englisch).
- ↑ R. A. Periana, O. Mirinov, D. J. Taube, S. Gamble: High Yield Conversion of Methane to Methyl Bisulfate Catalyzed by Iodine Cations. In: Chemical Communications. Nr. 20, 2002, S. 2376–2377, doi:10.1039/b205366g (englisch).
- ↑ Wolf, D: High Yields of Methanol from Methane by C-H Bond Activation at Low Temperatures. In: Angewandte Chemie International Edition. Nr. 24, 1999, S. 3351–3353, doi:10.1002/(SICI)1521-3773(19981231)37:24<3351::AID-ANIE3351>3.0.CO;2-U (englisch).
- ↑ R. A. Periana, D. J. Taube, S. Gamble, H. Taube, T. Satoh, H. Fujii: Platinum Catalysts for the High-Yield Oxidation of Methane to a Methanol Derivative. In: Science. Nr. 5363, 1998, S. 560–564, doi:10.1126/science.280.5363.560 (englisch).
- ↑ R. E. Robertson, S.E. Sugamon: The Hydrolysis of Dimethyl Sulfate and Diethyl Sulfate in Water. In: Canadian Journal of Chemistry. Nr. 14, 1966, S. 1728–1730, doi:10.1139/v66-260 (englisch).
- ↑ International nonproprietary names (INN) for pharmaceutical substances. World Health Organization
